2011年3月日本福岛大地震引起的核泄漏污染物中包含 等放射性同位素。下列有关
等放射性同位素。下列有关 的说法中,正确的是
的说法中,正确的是
| A.质子数为53 | B.中子数为53 | C.质子数为131 | D.中子数为131 |
下列有机物属于烃的是
| A.CH3Cl | B.C6H6 | C.C6H12O6 | D.CH3CHO |
下列化合物中,属于原子晶体的是
| A.CO2 | B.NaOH | C.SiO2 | D.Si |
下列化合物中的化学键中,既有离子键又有共价键的是
| A.H2O | B.NaCl | C.NH4Cl | D.HCl |
下列化学用语表述正确的是
A.Na的原子结构示意图: |
| B.N2分子的结构式:N=N |
C.HC1的电子式: |
D.H2O分子的球棍模型: |
下列各项比较中,正确的是
| A.原子核外电子数:H>O>Al | B.元素非金属性:F>Cl>Br |
| C.热稳定性:PH3>H2S>HCl | D.碱性:LiOH>NaOH>KOH |
下列属于加成反应的是
| A.乙醇与乙酸在浓硫酸加热条件下反应 | B.乙烯通入溴的四氯化碳溶液 |
| C.苯与浓硝酸、浓硫酸的混合物共热 | D.乙醇在铜粉存在下与氧气反应 |
下列物质属于同分异构体的一组是
| A.淀粉和纤维素 |
| B.C2H6与C3H8 |
| C.O2与O3 |
D.CH3-CH2-CH2-CH3与 |
下列各反应中,符合下图所示能量变化的是
| A.金属钠与水的反应 | B.氢氧化钡晶体与氯化铵混合反 |
| C.氧化钙与水的反应 | D.酒精燃烧 |
能通过化学反应使溴水褪色,又能使高锰酸钾溶液褪色的是
| A.甲烷 | B.乙烯 | C.乙烷 | D.苯 |
有机物与生产、生活密切相关。下列说法不正确的是
| A.天然气的主要成分是甲烷 | B.棉花的主要成分是淀粉 |
| C.酒精类饮料中含有乙醇 | D.牛奶中含有蛋白质 |
下列说法正确的是
| A.油脂在酸性条件下水解的反应称为皂化反应 |
| B.煤的炼制方法中煤的气化和液化是物理方法,煤的干馏是化学方法 |
| C.石油裂化的目的是提高轻质油的产量和质量 |
| D.蛋白质溶液中加入饱和硫酸铵溶液,蛋白质发生变性 |
下列试剂中,能鉴别乙醇、乙酸和葡萄糖三种溶液的是
| A.水 | B.新制氢氧化铜浊液 | C.碳酸钠溶液 | D.紫色石蕊试液 |
如图为铜锌原电池示意图,下列说法不正确的是
| A.该原电池中,铜为正极 |
| B.该原电池中,电子由铜片经过导线流入锌片 |
| C.该原电池工作一段时间后,溶液的酸性减弱 |
| D.该原电池工作一段时间后,锌片质量减小 |
在25℃,101 k Pa下,0.2 mol C2H2完全燃烧生成CO2和H2O(l)时放出259.92 kJ热量。表示上述反应的热化学方程式正确的是
| A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(g) △H=+259.92 kJ/mol |
| B.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-259.92 kJ/mol |
| C.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=+2599.2 kJ/mol |
| D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2599.2 kJ/mol |
据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量更大,而且没有铅污染。其电池反应为:2Zn+O2=2ZnO,原料为锌粒、电解液和空气,则下列叙述正确的是
| A.锌为正极,空气进入负极反应 |
B.负极反应为:Zn-2 -=Zn2+ -=Zn2+ |
| C.正极发生氧化反应 |
D.正极反应为: Zn-2 -=Zn2+ -=Zn2+ |
相同温度和压强下,在容积为2 L的密闭容器中发生反应:2HI(g) H2(g)+I2(g),达到平衡状态的标志是
H2(g)+I2(g),达到平衡状态的标志是
| A.c(H2)保持不变 |
| B.拆开2 mol H-I共价键,同时生成1 mol H-H共价键 |
| C.HI、H2、I2的浓度比为2:1:1 |
| D.正反应和逆反应都已停止 |
短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为20。则下列说法不正确的是
| A.最高价氧化物的水化物的酸性:X<Z |
| B.原子半径大小:Y<X<W |
| C.氢化物的稳定性X<Y |
| D.X和Y形成的化合物升华破坏的是共价键 |
一定量的某有机物完全燃烧后,生成1 mol CO2和9 g H2O,该有机物可能是
| A.C3H8 | B.CH3CH2OH | C.CH3CHO | D.C2H2 |
在一密闭容器中加入A和B,各物质的物质的量浓度随着反应的进行,如图所示。下列说法不正确的是
A.该反应的化学方程式为5A+4B 4C
4C
B.2min时,该反应达到平衡,此时A、B、C的浓度比为5:4:4
C.用B的浓度变化表示2min内的速率为2mol/(L·min)
D.2min前,正反应速率逐渐减小,逆反应速率逐渐增大
(6分)按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液: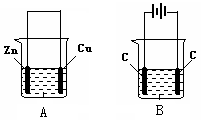
(1)A, B两个装置中,属于原电池的是 (填标号,下同)。
(2)B池中,右边C是 极,电极反应式为: ;
(3)A池中溶解了6.5g锌时,转移了 mol电子。
如图示是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等。回答:
(1)写出元素符号:A ;
(2)C的离子结构示意图: ;B的最高价氧化物对应水化物的化学式为__________。
(3)A、B、C三种元素的气态氢化物中最稳定的是 (填氢化物化学式)
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
回答下列问题:
(1)写出A的电子式 ;
(2)B、D分子中的官能团名称分别是 、 ;
(3)写出下列反应的反应类型:① ④ ;
(4)写出A→B反应的化学方程式:
A→B ;
(5)已知0.1mol液态的B完全燃烧生成液态水时放出136.68kJ热量,该反应的热化学方程式为 。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式 。
(2)浓硫酸的作用是:① ;② 。
(3)饱和碳酸钠溶液的主要作用是 。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是 。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
把0.6 mol X气体和0.6 mol Y气体混合于2 L体积不变的密闭容器中,使它们发生如下反应:2X(g)+ Y(g)=4Z(g)+2W(g)。2 min末生成0.2 mol W。计算:(1)前2min内用X的浓度变化表示的平均反应速率;(2)2min末Y的物质的量浓度。