和是氧元素的两种核素,表示阿伏伽德罗常数,下列说法正确的是()
| A. |
与
 互为同分异构体 互为同分异构体
|
| B. | 与 核外电子排布方式不同 |
| C. | 通过化学变化可以实现 与 间的相互转化 |
| D. | 标准状况下,1.12 和1.12 均含有0.1 个氧原子 |
下列与化学反应能量变化相关的叙述正确的是
| A. | 生成物能量一定低于反应物总能量 |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D. | 同温同压下, (在光照和点燃条件下的 不同 |
下列说法正确的是()
| A. | 形成离子键的阴阳离子间只存在静电吸引力 |
| B. | 、 、 、 的热稳定性和还原性均依次减弱 |
| C. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
下列叙述错误的是()
| A. | 乙烯和苯都使溴水褪色,褪色的原因相同 |
| B. | 淀粉、油脂、蛋白质都能水解,但水解的产物不同 |
| C. | 炼油可由石油分馏获得,可用作燃料和保存少量金属钠 |
| D. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和 溶液除去 |
下列推断正确的是
| A. | 是酸性氧化物,能与 溶液反应 |
| B. | 、 组成元素相同,与 反应产物也相同 |
| C. | 、 、 都是大气污染物气体,在空气中都能温室存在 |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分震荡后溶液显红色 |
下列与实验相关的叙述正确的是()
| A. | 稀释浓硫酸时,就将蒸馏水沿玻璃棒缓慢注入浓硫酸中 |
| B. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 |
| C. | 酸碱滴定时,若加入待测液前用待测液润洗锥形瓶,将导致测定结果偏高 |
| D. | 检验某溶液是否含有 时,应取少量该溶液,依次加入 溶液和稀盐酸 |
某温度下,分别在溶液中达到沉淀溶解平衡后,改变溶液,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是

| A. | |
| B. | 加适量 固体可使溶液由 点变到 点 |
| C. | 两点代表的溶液中 与 乘积相等 |
| D. | 、 分别在 、 两点代表的溶液中达到饱和 |
硫--碘循环分解水制氢主要涉及以下反应
I
Ⅱ
Ⅲ
(1)分析上述反应,下列判断正确的是
a.反应Ⅲ易在常温下进行 b.反应I中氧化性比强
c.循环过程中需补充 d.循环过程中产生1的同时产生1
(2)一定温度下,向1密闭容器中加入1 ,发生反应Ⅱ,物质的量随时间的变化如图所示。

0-2已见分晓的平均反应速率=,该温度下,的平衡常数=。
相同温度下,若开始加入的物质的量是原来的2倍,则是原来的2倍。
a.平衡常数 b.的平衡浓度 c.达到平衡的时间 d.平衡时的体积分数
(3)实验室用和稀硫酸制,反应时候溶液中水的电离平衡移动(填"向左"或"向右"或"不");若加入少量下列试剂中的,产生的速率将增大。
A. B. C. D.
(4)以为燃料可制作氢氧燃料电池。已知
某氢氧燃料电池释放228.8电能时,生成1液态水,该电池的能量转化率为。
对金属制品进行搞腐蚀处理,可延长其使用寿命。
(1)以下为铝村表面处理的一种方法:

①碱洗的目的是除去铝村表面的自然氧化膜,碱洗衣时候常有气泡冒出,原因是:(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的。
a. b. c. d.
②以铝村为阳极,在溶液中电解,铝村表面形成氧化膜,阳极电极反应式为:。取少量废电解液,加入溶液后产生气泡和白色沉淀,产生沉淀的原因是。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是。
(3)利用下图装置,可以模拟铁的电化学防护。

若为碳棒,为减缓铁的腐蚀,开关K应该置于处。
若为锌,开关置于处,该电化学防护法称为。
聚合硫酸铁又称聚铁,化学式,广泛用于汗水处理,实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量、 等)制备聚铁和绿矾(),过程如下:
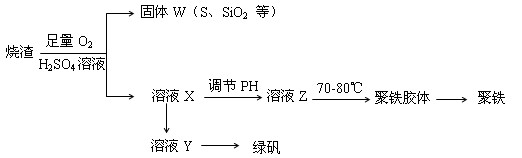
(1)验证固体焙烧后产生的气体含有的方法是。
(2)实验室制备,收集干燥的,所需仪器如下。装置A产生,按气流方向链接各仪器口,顺序为→→→→→。装置的作用是,装置中溶液的作用是。

(3)制备绿矾时,向溶液中加入过量,充分反应后,经操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。
(4)溶液的影响聚铁中铁的质量分数,用试纸测定溶液的操作方法为。若溶液的偏小,将导致聚铁中铁的质量分数偏。
玻璃钢可由酚醛树脂和玻璃纤维制成。
(1)酚醛树脂由酚醛和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向有苯酚的反应釜加入甲醛,且反应釜应装有装置。
(2)玻璃纤维由玻璃拉丝得到。普通玻璃由石英砂、和石灰石(或长石)高温熔融而成,主要反应的化学方程式为。
(3)玻璃钢中玻璃纤维的作用是。玻璃钢具有等优异性能(写出两点即可)
(4)下列处理废旧热固性酚醛塑料的做法合理的是
a.深埋
b.粉碎后用作树脂填料
c.用作燃料
d.用有机溶剂将其溶解,回收树脂
碳族元素包括:、、 、 、。
(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过杂化与周围碳原子成键,多层碳纳米管的层与层之间靠结合在一起。
(2)中共用电子对偏向,中共用电子对偏向,则、、的电负性由大到小的顺序 为。
为。
(3)用价层电子对互斥理论推断分子中的键角120°(填">""<"或"=")。
(4)铅、钡、氧形成的某化合物的晶胞结构是:处于立方晶胞顶点,处于晶胞中心,处于晶胞棱边中心,该化合物化学式为每个与个配位。
利用从冬青中提取的有机物合成结肠炎药物及其它化学品,合成路线如下:

根据上述信息回答:
(1)不与溶液反应,中官能团的名称是。的反应类型是。
(2)写出生成和的化学反应方程式。
(3)的同分异构体和是重要的医药中间体,在浓硫酸的作用下和分别生成 ,鉴别和的试剂为。
,鉴别和的试剂为。
(4)的另一种同分异构体用于合成高分子材料可由 制得,写出在浓硫酸作用下生成的聚合物的结构简式:。
制得,写出在浓硫酸作用下生成的聚合物的结构简式:。