下列物质中,可形成酸雨的是
| A. | 二氧化硫 | B. | 氟氯代烃 | C. | 二氧化碳 | D. | 甲烷 |
常温下,将0.1氢氧化钠溶液与0.06硫酸溶液等体积混合,该混合溶液的等于
| A. | 1.7 | B. | 2.0 | C. | 12.0 | D. | 12.4 |
对于化学反应,下列反应速率关系中,正确的是
| A. | B. | C. | D. |
把含有和的混合溶液分成两等份,一份加入含的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
| A. | B. | ||
| C. | D. |
已知:, ,,则下列难溶盐的饱和溶液中,浓度大小顺序正确的是()
| A. | B. | ||
| C. | D. |
光谱研究表明,易溶于水的所形成的溶液中存在着下列平衡:

据此,下列判断中正确的是
| A. | 该溶液中存在着 分子 |
| B. | 该溶液中 浓度是 浓度的2倍 |
| C. | 向该溶液中加入足量的酸都能放出 气体 |
| D. | 向该溶液中加入过量 可得到 、 和 的混合溶液 |
下列物质中既有氧化性又有还原性的是()
| A. | B. | C. | D. |
下列化合物中既易发生取代反应,也可发生加成反应,还能使酸性溶液褪色的是()
| A. | 乙烷 | B. | 乙醇 | C. | 丙烯 | D. | 苯 |
利用电解法可将含有、、、等杂质的粗铜提纯,下列叙述正确的是()
| A. | 电解时以纯铜作阳极 |
| B. | 电解时阴极发生氧化反应 |
| C. | 粗铜连接电源负极,电极反应是 |
| D. | 电解结束,电解槽底部会形成含少量 、 等阳极泥 |
短周期元素、、所在的周期数依次增大,它们的原子序数之和为20,且与核外电子层的结构相同。下列化合物中同时存在极性和非极性共价键的是()
| A. | B. | C. | D. |
下列化合物分子中的所有原子都处于同一平面的是
| A. | 溴苯 | B. | 对二甲苯 | C. | 氯乙烯 | D. | 丙烯 |
各物质间的关系如下图,其中、为气态单质。

请回答下列问题:
(1)物质和的名称分别为、;
(2)可选用不同的进行反应①,若能在常温下进行,其化学方程式为;
若只能在加热情况下进行,则反应物应为;
(3)反应②的化学方程式为;
(4)新配制的溶液应加入以防止其转化为。检验溶液中阳离子的常用试剂是,实验现象为。
高炉炼铁过程中发生的主要反应为
已知该反应在不同温度下的平衡 常数如下:
常数如下:

请回答下列问题:
(1)该反应的平衡常数表达式=,0(填">"、"<"或"=");
(2)在一个容积为10的密闭容器中,1000℃时加入、、、各1.0 ,反应经过l0后达到平衡。求该时间范围内反应的平均反应速率=、的平衡转化率=:
(3)欲提高(2)中的平衡转化率,可采取的措施是。
A.减少的量
B.增加的量
C. 移出部分
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂
是自然界存在最广泛的族元素,常以化合物存在。从单质A起始发生的一系列化学反应可由下图表示:

请回答下列问题:
(1)与水反应的化学方程式为,与水反应的化学方程式为;
(2)的化学式为,和的电子式分别为;
(3)与反应可能生成的盐有(填化学式);
(4)实际生产中,可由为原料制备单质,简述一种制备方法。
有机物可作为植物生长调节剂,为便于使用,通常将其制成化合物 ,在弱酸性条件下会缓慢释放出。合成的一种方法及各物质间转化关系如下图所示:
,在弱酸性条件下会缓慢释放出。合成的一种方法及各物质间转化关系如下图所示:

请回答下列问题:
(1)的名称是_,与氯气反应可生成,的名称是;
(2)经测定中含有氯元素,且可以与乙酸发生酯化反应,则的结构简式为,由直接生成的反应类型是;
(3)在弱酸性条件下,与水反应生成的化学方程式为;
(4)写出的两个同分异构体的结构简式。
(I已知: ,如果要合成
,如果要合成 所用的原始原料可以是
所用的原始原料可以是
A. 2-甲基-l,3-丁二烯和2-丁炔 B.1,3-戊二烯和2-丁炔
C.2,3-二甲基-1,3-戊二烯和乙炔 D、2,3-二甲基-l,3-丁二烯和丙炔
II都是有机化合物,它们的转化关系如下:

请回答下列问题:
(1)已知:6.0化合物完全燃烧生成8.8和3.6;的蒸气与氢气的相对密度为30,则的分子式为:
(2)为一取代芳烃,中含有一个甲基。由生成的化学方程式为;
(3)由生成、由生成的反应条件分别是、;
(4)由生成、由生成的反应类型分别是、;
(5) 存在于栀子香油中,其结构简式为;
存在于栀子香油中,其结构简式为;
(6)在的同分异构体中,苯环上一硝化的产物只有一种的共有个,其中核磁共
振氢谱有两组峰,且峰面积比为l:1的是 (填结构简式)。
I下列描述中正确的是()
| A. | 为 形的极性分子 |
| B. | 的空间构型为平面三角形 |
| C. | 中有6对完全相同的成键电子对 |
| D. | 和 的中心原子均为 杂化 |
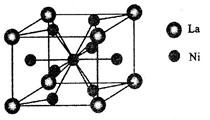
Ⅱ金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)原子的核外电子排布式为;
(2)、的晶体结构类型均与氯化钠的相同,和的离子半径分别为69和78 ,则熔点(填"<"或">");
(3)晶胞中和的配位数分别为、;
(4)金属镍与镧()形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为;

(5)丁二酮肟常用于检验:在稀氨水介质中,丁二酮肟与反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是键,碳氮之间的共价键类型是,氮镍之间形成的化学键是;
②该结构中,氧氢之间除共价键外还可存在;
 ③该结构中,碳原子的杂化轨道类型有。
③该结构中,碳原子的杂化轨道类型有。
Ⅰ固硫剂是把煤燃烧时生成的二氧化硫以盐的形式固定在炉渣中的物质,可减少二氧化硫对大气的污染。下列物质中可用做固硫剂的有
| A. | B. | C. | D. |
Ⅱ以黄铁矿为原料,采用接触法生产硫酸的流程可简示如下:

请回答下列问题:
(1)在炉气制造中,生成的化学方程式为;
(2)炉气精制的作用是将含的炉气、及干燥,如果炉气不经过精制,对催化氧化的影响是 :

(3)精制炉气(含体积分数为7%、为ll%、为82%)中平衡转化率与温度及压强关系如下图所示。在实际生产中,催化氧化反应的条件选择常压、450℃;左右(对应图中点),而没有选择转化率更高的或点对应的反应条件,其原因分别是、;
(4)在催化氧化设备中设置热交换器的目的是、,从而充分利用能源。
根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量么(近似值)的实验。先称量反应物氧化铜的质量(),反应完全后测定生成物水的质量 (),由此计算。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的与的量足以产生使完全还原的氨气):
(),由此计算。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的与的量足以产生使完全还原的氨气):

请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)→;
(3)在本实验中,若测得()="" ,(2)= "",则=;
(4)在本实验中,使测定结果偏大 的是 (填序号);
的是 (填序号);
①未完全起反应 ② 不 干燥
干燥
③中混有不反应的杂质 ④碱石灰不干燥
⑤与混合物不干燥
(5)在本实验中,还可通过测定和,或和达到实验目的。
能正确表示下列反应的离子方程式是
| A. | 金属铝溶于稀硫酸中: ↑ |
| B. | 碳酸锌溶于稀硝酸中: ↑ |
| C. | 醋酸钠水溶液中通入足量 : |
| D. | 少量 通入 溶液中: |