下列所示都是错误的实验操作,关于产生的不良后果的描述中哪项不正确?( )

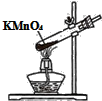

| A.标签被腐蚀 | B.试管破裂 | C.吹不灭酒精灯 | D.读数偏大 |
如图为小明学习原子内部结构后制作的某原子结构模型:外圈上的小球代表电子,内圈为原子核。则下列说法中不正确的是( )
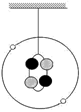
| A.该原子的相对原子质量为4 |
| B.该原子的核电荷数为4 |
| C.该原子的质量主要集中在原子核上 |
| D.该原子的原子核由2个带正电的质子和2个不带电的中子构成 |
20℃时,取下表中的四种物质各20克,加入到100克水中充分溶解,最终有固体剩余的是( )
| 常见物质的溶解度(20℃) |
||||
| 物质名称 |
氯酸钾 |
硝酸钾 |
氯化钠 |
蔗糖 |
| 溶解度/克 |
7.4 |
31.6 |
36.0 |
203.9 |
A.氯酸钾 B.硝酸钾 C.氯化钠 D.蔗糖
下列物质露置于空气中一段时间,一定没有发生化学变化且质量增大的是( )
| A.浓硫酸 | B.浓盐酸 | C.生石灰 | D.氢氧化钠 |
“舌尖上的中国”第二季的热播让厨房再次成为人们施展厨艺的舞台,其实厨房也是同学们的家庭实验室。下列实验中无法利用厨房物品完成的是( )
| A.探究铁制品在什么条件下容易生锈 |
| B.比较食盐、蔗糖在水中的溶解能力 |
| C.检验味精中氯化钠的含量 |
| D.用食醋鉴别纯碱和食盐 |
将质量相等的a、b两块金属分别放入溶质质量分数相同的足量稀硫酸中充分反应,生成的氢气的质量m与反应时间t的关系如图所示(产物中a、b两种元素的化合价均为+2价)。则下列有关描述可能错误的是( ):
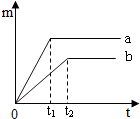
| A.金属的活动性强弱:a>b | B.产生H2的质量是:a>b |
| C.相对原子质量是:a<b | D.完全反应后所得溶液的质量:a<b |
已知某溶液中存在五种离子,各离子间的个数比为:
Cl-∶SO42-∶Fe3+∶K+∶M=2∶3∶1∶3∶1,则M可能为( ):
| A.CO32- | B.Mg2+ | C.Na+ | D.Ba2+ |
在Mg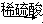 MgSO4
MgSO4 Mg(OH)2
Mg(OH)2 MgO的各步转化中,反应所属的基本反应类型不包括( )
MgO的各步转化中,反应所属的基本反应类型不包括( )
| A.化合反应 | B.复分解反应 | C.置换反应 | D.分解反应 |
分类是学习和研究物质及其变化的一种常用方法。分类要有一定的标准。如果按照物质的组成对赤铁矿、纯碱、氧气、烧碱、水、硫酸六种物质进行分类,则图中虚线框内的物质①、②、③、④、⑤、⑥依次为( )
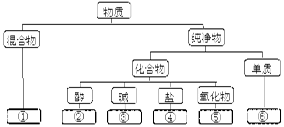
| A.赤铁矿、硫酸、纯碱、烧碱、水、氧气 |
| B.水、硫酸、烧碱、纯碱、赤铁矿、氧气 |
| C.赤铁矿、硫酸、烧碱、纯碱、水、氧气 |
| D.水、硫酸、纯碱、烧碱、赤铁矿、氧气 |
在氢氧化钠溶液中加入一定量的稀盐酸后,下列哪种情形说明两者恰好完全中和?( ):
| A.滴入适量FeCl3溶液,溶液变黄,但无沉淀生成。 |
| B.滴入几滴酚酞试液,酚酞试液不变色。 |
| C.测得反应后溶液中Na+与Cl-的个数比为1:1。 |
| D.滴入适量AgNO3溶液和稀硝酸,观察到有白色沉淀。 |
下列各组物质中,能相互反应且反应前后溶液总质量保持不变的是( )
| A.铝和硫酸铜溶液 | B.稀硫酸和烧碱溶液 |
| C.氧化铁固体和盐酸 | D.碳酸钾溶液和硝酸钠溶液 |
某电镀厂的电镀液中含有金盐,为了回收其中的金元素,技术人员制作了如图所示的“吸金球”。“吸金球”是装有一些“吸金”物质的纱袋,使用时只要把“吸金球”浸入电镀液,过一会提起来,就能“吸”出盐溶液中的金。据上所述,“吸金球”中用于“吸金”物质可能是( ):

A.磁石(主要成分是Fe3O4)
B.铁屑(Fe)
C.胆矾(CuSO4·5H2O)
D.活性炭(C)
为适应火车提速,沪宁线上原有的短轨已全部连接为超长轨。工程技术人员常用如下反应来焊接钢轨间的缝隙:2Al+Fe2O3 ="=" Al2O3+2Fe,其中还原剂是( ):
| A.铁 | B.氧化铝 | C.氧化铁 | D.铝 |
下表所列各组物质中,物质之间按箭头所示方向的转化通过一步反应就能实现的是( )
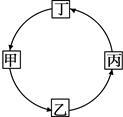
| 选项 |
物质 |
|||
| 甲 |
乙 |
丙 |
丁 |
|
| A |
CO2 |
CaCO3 |
H2O |
O2 |
| B |
NaOH |
NaCl |
CO2 |
Na2CO3 |
| C |
H2O2 |
H2O |
O2 |
MgO |
| D |
CaO |
Ca(OH)2 |
H2O |
CaCl2 |
下列生活用品所含的主要材料,属于有机合成材料的是( )
| A.真丝围巾 | B.纯棉袜子 | C.不锈钢锅 | D.塑料水桶 |
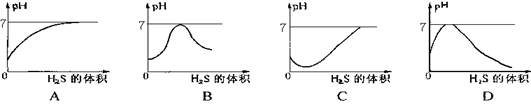
二氧化硫气体是造成酸雨的主要气体,其水溶液叫亚硫酸(H2SO3)。硫化氢(H2S)是一种具有臭鸡蛋气味的剧毒气体,其水溶液叫氢硫酸。已知相同的条件下,氢硫酸的酸性弱于亚硫酸。现在室温下向饱和的亚硫酸溶液中通入过量的硫化氢气体,反应的化学方程式为:2H2S + H2SO3 ="=" 3S↓ + 3H2O。则下图中溶液的pH随通入硫化氢体积的变化曲线示意图正确的是( )
为了除去粗盐中的Ca2+、Mg2+、SO42-及泥砂,可将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液。则下列操作顺序中最合适的是( )
| A.②④⑤①③ | B.⑤④②③① | C.②⑤④①③ | D.⑤②④③① |
现有Zn、Fe2O3、MgCl2、Cu(OH)2、稀H2SO4五种物质,在常温下两两相遇,能发生的化学反应有( )
| A.3个 | B.4个 | C.5个 | D.6个 |
小明在做“探究串联电路中电流的关系”的实验时,闭合开关后,小灯泡不亮,电流表无示数。于是他用一根导线接在L1两端时,灯仍不亮,电流表无示数。当接在L2两端时,灯亮了,电流表也有了示数。则电路可能出现的故障是( )

| A.电流表短路 | B.灯L1开路 |
| C.开关接触不良 | D.灯L2开路 |
如图所示电路中,A、B间的电压保持不变,电阻R1、R2为定值电阻。断开开关S,甲、乙均为电流表时,甲、乙两表的示数之比为3:4。若闭合开关S,甲、乙均为电压表,则甲、乙两表的示数之比是( )

A.4:3 B.3:4 C.3:7 D.4:7
在H、O、C、Cl、Na、Ca六种元素中选择适当元素组成符合要求的物质,将其化学式填入空格:
(1)改良酸性土壤的碱 ;(2)可做干燥剂的氧化物 ;
(3)可做建筑材料的盐 ;(4)汽水中含有的酸 ;
(5)厨房中常用的调味品 ;(6)相对分子质量最小的有机物 。
用毛笔蘸取溶质质量分数为5%的稀硫酸在竹片上画花,然后把竹片放在小火上烘干,再用水洗净,在竹片上就得到黑色或褐色的花样,一幅精美的竹片画就制成了。
(1)稀硫酸在烘干的过程中成为浓硫酸,使富含纤维素的竹片呈现黑色或褐色,在这个过程中竹片发生了 变化(选填“物理”或“化学”)。
(2)直接用浓硫酸在竹片上画花具有危险性,必须将浓硫酸进行稀释。在实验室把100克溶质质量分数为98%的浓硫酸稀释成5%的稀硫酸,需用量筒量取 毫升的蒸馏水用于稀释。
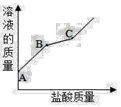
敞口放置的氢氧化钠溶液易吸收空气中的二氧化碳而变质,请写出此过程的化学方程式: 。现向一定质量且部分变质的氢氧化钠溶液中逐滴加入稀盐酸,并振荡。如图表示反应过程中溶液质量随加入盐酸质量的变化而变化的情况。那么,图线BC段对应的实验现象是 ,在B点时溶液中的溶质是 。
“五水共治”的首要任务是“治废水”,合理处理废水是当前防治废水污染的重要举措。某化工厂有甲、乙、丙、丁四个车间,排放的废水中分别含有FeCl3、HCl、Na2CO3、NaOH的一种,甲车间的废水呈黄色。通过调节废水流量,使乙、丁两个车间废水相对过量,通过如图方式处理,最终可使排出的废水呈中性。处理时第①反应池中出现大量的红褐色沉淀,第②反应池中出现大量的气泡。请回答:
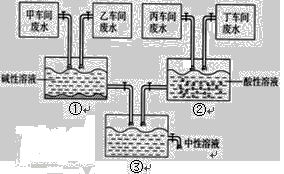
(1)乙车间排放的废水主要成分是 。
(2)第②个反应池的废水中的溶质是 (用化学式表示)。
(3)写出第③反应池中的化学反应方程式: 。
在A、B、C、D四支试管中分别盛有CuSO4、NaCl、BaCl2、BaCO3四种白色固体,某同学在只有蒸馏水和若干试管的条件下,将它们一一鉴别出来:
步骤一:取四种固体各少量,分别放入4支试管中,各加入适量的水,观察。根据物质的溶解性及溶液的颜色可鉴别出 ;
步骤二:鉴别余下物质。具体操作方法及相关现象、结论为: ,有关反应的化学方程式为 。
为判断短跑比赛中运动员是否抢跑,某兴趣小组设计了如图所示“抢跑自动指示”电路。其工作原理是:当运动员蹲在起跑器上后,先闭合总开关S;发令时闭合发令开关S1,则发令指示灯亮;运动员听到“起跑”命令起跑后,装在起跑器上的压敏电阻R0立即因受到压力减小,其电阻改变,电磁铁线圈中的电流明显变大,开关S2被吸引而闭合,于是起跑器指示灯亮。

(1)压敏电阻有以下两种类型,则该模型的压敏电阻R0属于哪种类型? :
A.阻值随压力增大而增大 B.阻值随压力增大而减小
(2)运动员抢跑时指示灯的发光情况为: 。
(3)已知发令控制电路的电源电压U=6伏,运动员起跑后,电磁铁线圈中的电流为0.25安。若压敏电阻R0的阻值为30欧姆,电磁铁线圈的电阻忽略不计,则发令指示灯的电阻为 欧姆。
某化学兴趣小组,设计了如右图所示装置来研究空气中氧气的体积分数:用一个50mL量筒倒扣在水中,使量筒内外液面均位于40mL处。量筒内浮着一个铜制的小船,船中放有足量白磷。现把浓硫酸缓缓倒入水中并搅拌。一会儿,白磷发生自燃,量筒内液面上升。向水槽内加水直至量筒内外液面相平,读出此时液面所对刻度。

(1)加入浓硫酸的目的是 ;
(2)放白磷的小船用铜做的原因是 ;
(3)最终,液面大约位于量筒刻度 处;
(4)为何要向水槽内加水至内外液面相平? ;
(5)该兴趣小组选用的仪器有何缺陷? 。
日常生活中,切开的苹果很快就会
“生锈”。小亮查到了相关资料:当苹果被切开时,空气中的氧气就会与苹果中的一些物质发生反应,使之变成褐色。苹果“生锈”以后,所含的维生素C质量会减少,营养价值会降低。小亮对此展开了探究:
猜想:(1)苹果“生锈”可能与空气中的氧气有关。 (2)“生锈”的快慢还可能与温度有关。
实验:
| |
实验操作(观察30分钟) |
实验结果 |
| 甲 |
将一小块苹果浸入装满蒸馏水(已除去氧气)的集气瓶中,观察现象。 |
果肉表面不变色。 |
| 乙 |
将一小块苹果放入充满氧气的集气瓶中,观察现象。 |
果肉表面 。 |
| 丙 |
将一小块苹果放入充满氧气的集气瓶中,再浸入热水里,观察现象。 |
果肉表面很快变色,且颜色很深。 |
(1)由 两组实验可以验证苹果“生锈”是否与空气中的氧气有关。
(2)实验结论之一:苹果“生锈”的速度与温度有关,温度越高,变色越快。请你补充乙组的实验结果:果肉表面 。
(3)为了防止切开后的苹果“生锈”,可以采取的措施有 。
天然气作为燃料已进入千家万户。小聪在帮父母烧菜时想到:天然气燃烧的产物是什么呢?带着这一问题,小聪和同学们一起进行了探究:
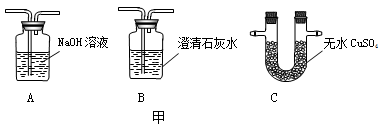
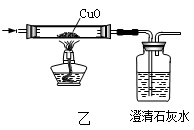
探究一:天然气的主要成分是甲烷(CH4),燃烧后的产物中可能有二氧化碳、水,同学们想利用甲图中的装置进行验证,请你帮助他们选择合理的装置并连接:燃烧后的混合气体应依次通过 装置。
探究二:甲烷燃烧会不会因氧气不足而生成一氧化碳呢?
同学们提出可用乙图装置加以检验,那么气体通入该装置之前应怎样处理?他们讨论后一致认为:
先把燃烧后的混合气体依次通过甲图中的A、B、C装置,然后再通入乙图装置。如果看到 现象则表明燃烧产物中有一氧化碳。注意事项:混合气体通过乙装置进行实验时,应先通气体、再加热,这样做的目的是 。小聪认为上述方案还存在缺陷,请你指出来: 。
化学小组同学对酸的性质很感兴趣,向老师提出研究硝酸的性质,老师高兴答应并带领同学们进行了硝酸性质的实验探究。
实验设计:(1)将石蕊试液滴入稀硝酸中,预计石蕊试液由紫色变色。
(2)将Zn片投入稀硝酸中,预计将产生氢气。
实验验证:同学们按上述设计做了实验,却发现石蕊变色后一会儿即褪去;Zn片投入稀HNO3后,溶
液中冒出气泡,产生无色气体A,在试管口气体A变成红棕色有刺激性气味的气体B。
提出问题:(1)石蕊试液变色后为何会褪色?
(2)上述产生的无色气体是什么? 硝酸具有哪些特性?
查阅资料:看到如此异常的现象,在老师的指导下,同学们上网查到了下列资料:
(1)硝酸可与Zn、Cu等多种金属反应生成相应的硝酸盐,但不生成H2。
(2)含有氮元素的某些气态物质的物理性质:
| |
NH3 |
N2 |
NO |
NO2 |
| 顏色 |
无色 |
无色 |
无色 |
红棕色 |
| 溶解性 |
极易溶于水 |
不溶于水 |
不溶于水 |
可溶于水或硝酸 |
猜想与分析:
(1)小明同学认为石蕊变色后又褪色的原因是由于试管不干净,含有其他杂质造成的,要证明小明的观点,应进行的操作是 。
(2)大家一致认同了红棕色气体B是NO2,但对于无色气体A及变化的原因有不同的看法:
①小丽同学认为A是NH3,但遭到大家的一致反对,原因是 ;
②小强同学认为A是N2,也遭到大家的一致反对,原因是
③经讨论,最终大家获得了“A是NO”的共识。NO遇氧变成NO2的化学方程式为 。
实验探究:小红同学对硝酸能与Cu反应很感兴趣,便取了一小块铜片投入稀HNO3中,发现Cu溶解,
也出现上述Zn与稀HNO3反应的类似现象,确证生成了NO,并在老师的帮助下,测出恰好
反应的Cu和HNO3的质量比为8:21,由此获得了Cu与稀HNO3的反应方程式为 。
交流反思:根据探究结果可知:稀HNO3能跟铜反应的原因是硝酸具有氧化性 。
我国早在西汉时期,就能利用铁与硫酸铜溶液反应制取铜,沈括在其《梦溪笔谈》以“曾青得铁化为铜”记之,该反应的化学方程式为 。小张同学对此很感兴趣,他利用硫酸铜进行趣味实验,将浸泡了蓝色硫酸铜溶液的滤纸放在酒精灯火焰上点燃,观察到滤纸颜色变白,由湿变干后燃烧。在燃烧后的灰烬中出现红色固体。他很好奇,并进行了相关探究。
提出问题:红色固体是什么物质?它是如何产生的?
查阅资料:
(1)温度达200℃时,CuSO4开始分解生成CuO和另一种氧化物;此反应前后各元素的化合价保持不变。
(2)温度超过1000℃,CuO才分解生成氧化亚铜(Cu2O),Cu2O呈红色。
作出猜想:红色固体①可能是Cu;②也可能是Cu2O;③还可能是 。
实验探究:
(1)取红色固体观赏,呈亮红色;
(2)取少量红色固体于试管中,加入稀硫酸,固体不溶解,溶液仍为无色。
分析推理:
(1)请教老师后得知,如有Cu2O存在,加入稀硫酸会发生如下反应:Cu2O+H2SO4===CuSO4+Cu+H2O,同学们结合实验探究的现象,确定亮红色固体为 。
(2)滤纸主要是由碳、氢、氧三种元素组成的,经分析,产生红色固体的原因可能是滤纸在燃烧过程中产生的碳与分解产生的CuO发生反应,生成亮红色固体和二氧化碳。该反应的化学方程式为 ,这说明滤纸燃烧时的温度低于 ℃。
交流讨论:
(1)将浸有硫酸铜溶液的滤纸点燃,刚开始不能燃烧,是因为 。
(2)此实验中,CuSO4受热分解生成CuO和 (填化学式)。
实验室购买了一捆标注长度为 100m 的铜导线,某同学想通过实验测定其实际长度。该同学首先测得导线横截面积为 1.0mm2,查出导线每 1m 的电阻为 1.7×10 -2Ω再利用图甲所示电路测出整捆铜导线的电阻 Rx,从而确定导线的实际长度。可供使用的器材有:电流表(0~0.6A),电压表(0~3V),滑动变阻器R1(“5Ω,1A”)、R2(“25Ω,1A”),电源(电压6V),开关导线若干。
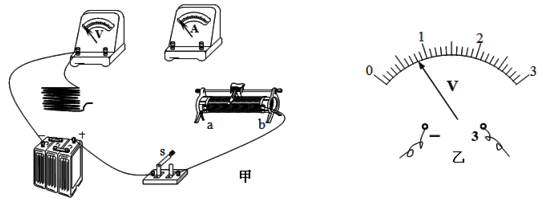
回答下列问题:
(1)实验滑动变阻器应选 (填 R1或R2)。
(2)请在答题纸上图甲中用笔画线代替导线完成剩余部分的连接。
(3)调节滑动变阻器,当电流表的读数为 0.50A 时, 电压表示数如图乙所示,读数为 V。
导线实际长度为 m(保留一位小数)。
2015年5月,某市居民发现自来水有股奇怪的味道,经专家多轮综合检测,基本认定引起引起异味的主要物质是邻叔丁基苯酚。将30g邻叔丁基苯酚完全燃烧,生成88gCO2和25.2gH2O(无其他产物)。已知邻叔丁基苯酚的相对分子质量为150,求:
(1)CO2中碳、氧元素的质量比_______________。
(2)30g邻叔丁基苯酚中含碳元素质量是______________g。
(3)邻叔丁基苯酚的化学式为__________________。
小科同学想测定Cu-Zn合金和Cu-Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀盐酸和必要的仪器。
(1)你认为能测出Cu的质量分数的是___________合金。
(2)小科同学取该合金32.5g,与足量的该盐酸充分反应,经测定,产生了0.4g气体。请计算该合金中Cu的质量分数。_______________
(3)若想测出该盐酸的质量分数,你认为实验时必须提供和测出哪些数据? __________ :
①参加反应的合金质量 ②参加反应的稀盐酸的质量 ③产生气体的质量
我校初二学生去桐庐瑶琳仙境春游,带回了几小块石灰石样品。为了检测样品中碳酸钙的含量,甲、乙、丙、丁四位同学用质量分数相同的稀盐酸与样品充分反应来讲行实验测定(样品中的杂质不溶于水,且不与盐酸反应),测得如下表数据,试问答:
| |
甲同学 |
乙同学 |
丙同学 |
丁同学 |
| 石灰石样品的质量(g) |
10.0 |
10.0 |
10.0 |
10.0 |
| 加入稀盐酸的质量(g) |
20.0 |
30.0 |
45.0 |
50.0 |
| 剩余固体的质量(g) |
6.0 |
4.0 |
1.0 |
1.0 |
(1) 同学的实验中稀盐酸有剩余, 同学的实验中碳酸钙有剩余。
(2)样品中碳酸钙的质量分数是__ ___,同学们使用的稀盐酸的溶质质量分数是 。
在硫酸与硫酸铜的混合溶液200克中,滴入40%的氢氧化钠溶液100克,恰好完全反应。记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示。
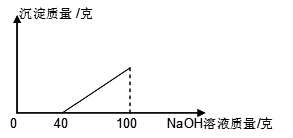
(1)试分析在混合溶液中滴加氢氧化钠时,为什么没有立即产生沉淀? 。
(2)当滴加50克氢氧化钠溶液时,混合溶液中的溶质是(用化学式表示) 。
(3)200克混合溶液中,硫酸的溶质质量分数为 。
(4)完全反应时,所得溶液中的溶质质量分数为 。
向质量为m的 20%的氢氧化钠溶液中逐滴加入硫酸镁溶液,至恰好完全反应时,滤去沉淀,称得滤液总质量为3m 。
(1)计算所加硫酸镁溶液中溶质的质量分数(最后结果精确到0.1%);
(2)请建立坐标系绘制上述滴加过程中各种不同离子的数目随硫酸镁溶液的不断加入而变化的关系图。