化学与生产、生活密切相关。下列叙述正确的是
| A. | 煤的干馏和石油的分馏均属化学变化 |
| B. | 在医学上用作钡餐, 对人体无毒 |
| C. | 可用于文物年代的鉴定, 与 互为同素异形体 |
| D. | 葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 |
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素
| A. | 在自然界中只以化合态的形式存在 |
| B. | 单质常用作左半导体材料和光导纤维 |
| C. | 最高价氧化物不与酸反应 |
| D. | 气态氢化物比甲烷稳定 |
下列与有机物结构、性质相关的叙述错误的是()
| A. | 乙酸分子中含有羧基,可与NaHCO 3溶液反应生成 |
| B. | 蛋白质和油脂都属于高分子化合物,一定条件下能水解 |
| C. | 甲烷和氯气反应生成一氯甲烷,苯和硝酸反应生成硝基苯的反应类型相同 |
| D. |
苯
 不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
|
、、都是重要的金属元素。下列说法正确的是()
| A. | 三者对应的氧化物均为碱性氧化物 |
| B. | 三者的单质放置在空气中均只生成氧化物 |
| C. | 制备 、 、 均不能采用将溶液直接蒸干的方法 |
| D. | 电解 、 、 的混合溶液时阴极上依次析出 、 、 |
元素的原子结构决定其性质和周期表中的位置。下列说法正确的是
| A. | 元素原子的最外层电子数等于元素的最高化合价 |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较高 |
| C. | 得电子能力和最高价氧化物对应的水化物的酸性均依次增强 |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
室温下向10 =3的醋酸溶液中加入水稀释后,下列说法正确的是
以和混合液为电镀液在铁制品上镀锌,下列说法正确的是
| A. | 未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程 |
| B. | 因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |
| C. | 电镀时保持电流恒定,升高温度不改变电解反应速率 |
| D. | 镀锌层破损后对铁制品失去保护作用 |
研究、 、等大气污染气体的处理具有重要意义。
(1)可用水吸收,相应的化学反应方程式为。利用反应 也可处理。当转移1.2电子时,消耗的在标准状况下是L。
也可处理。当转移1.2电子时,消耗的在标准状况下是L。
(2)已知:
 则反应
则反应 的。
的。
一定条件下,将与以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
a.体系压强保持不变
b.混合气体颜色保持不变
c.和的体积比保持不变
d.每消耗1 的同时生成1
测得上述反应平衡时与体积比为1:6,则平衡常数K=。
(3)可用于合成甲醇,反应方程式为 。
。
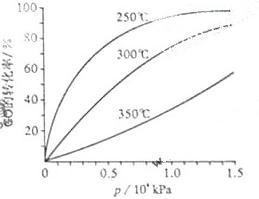
在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH0(填">"或" <")。实际生产条件控制在250℃、1.3×104左右,选择此压强的理由是。
科研、生产中常涉及钠、硫及其化合物。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为。要清洗附着在试管壁上的硫,可用的试剂是。
(2)右图为钠硫高能电池的结构示意图,该电池的工作温度为320左右,电池反应为,正极的电极反应式为。(由和制得)的两个作用是。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的倍。

(3)溶液中离子浓度由大到小的顺序为,向该溶液中加入少量固体,溶液(填"增大""减小"或"不变"),溶液长期放置有硫析出,原因为(用离子方程式表示)。
实验室以含有、、、、等离子的卤水为主要原料制备无水和,流程如下:

(1)操作Ⅰ使用的试剂是,所用主要仪器的名称是。
(2)加入溶液W的目的是。用调节溶液Y的,可以除去。由表中数据可知,理论上可选择最大范围是。酸化溶液Z时,使用的试剂为。

(3)实验室用贝壳与稀盐酸反应制备并收集气体,下列装置中合理的是。
| A. |
a. |
| B. |
b. |
| C. |
c. |
| D. |
d. |
(4)常温下,的电离常数,,的电 离常数,。某同学设计实验验证酸性强于:将和气体分别通入水中至饱和,立即用酸度计测两溶液的,若前者的小于后者,则酸性强于。该实验设计不正确,错误在于。
离常数,。某同学设计实验验证酸性强于:将和气体分别通入水中至饱和,立即用酸度计测两溶液的,若前者的小于后者,则酸性强于。该实验设计不正确,错误在于。
设计合理实验验证酸性强于(简要说明实验步骤、现象和结论)。。仪器器自选。
供选的试剂:、、、、、、蒸馏水、饱和石灰水、酸性 溶液、品红溶液、试纸。
水处理技术在生产、生活中应用广泛。
(1)含有较多
(2)将型阳离子交换树脂和型阴离子交换树脂串接来软化天然硬水,应先使硬水通过
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为
(4)检验蒸馏水的纯度时,最简单易行的方法是测定水的
氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为个.
(2)分子内的键、分子间的范德华力和氢键从强到弱依次为。
 沸点比
沸点比 高,原因是.
高,原因是.
(3)可与形成,中原子采用杂化。中键角比中键角大,原因为。
(4)与的晶胞同为面心立方结构,已知晶体密度为ag cm-3,表示阿伏加德罗常数,则晶胞体积为Cm3。
cm-3,表示阿伏加德罗常数,则晶胞体积为Cm3。
美国化学家因发现如下反应而获得2010年诺贝尔化学奖。
 (为卤原子,为取代基)
(为卤原子,为取代基)
经由反应合成(一种防晒剂)的路线如下:

回答下列问题:
(1)可发生的反应类型是。
a.取代反应 b.酯化反应
c.缩聚反应 d.加成反应
(2)与浓共热生成,能使酸性溶液褪色,的结构简式是。
在一定条件下反应生成高分子化合物,的结构简式是。
(3)在的反应中,检验是否反应完全的试剂是。
(4)的一种同分异构体符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢,与溶液作用显紫色。与过量溶液共热,发生反应的方程式为。