造成环境污染的主要原因大多是由于人类生产活动中过度排放有关物质引起的。下列环境问题与过度排放的物质对应不正确的是
| A.雾霾——CO | B.白色污染——废弃塑料 |
| C.酸雨——SO2 | D.温室效应——CO2 |
下列气体为红棕色的是
| A.NO2 | B.NO | C.SO2 | D.N2 |
下列分散系属于胶体的是
| A.白酒 | B.矿泉水 | C.白醋 | D.豆浆 |
下列物质中,溶于水且能发生电离的是
| A.硫酸钡 | B.Cu | C.NaCl | D.蔗糖 |
下列物质中,不属于合金的是
| A.碳素钢 | B.水银 | C.青铜 | D.黄铜 |
分类是学习和研究化学的一种重要方法,下列分类不合理的是
| A.FeCl2属于盐 | B.Na2O属于酸性氧化物 |
| C.KOH属于碱 | D.H2SO4属于酸 |
下列电离方程式书写错误的是
| A.Na2CO3 = 2Na++ CO32- | B.H2O= 2H++O2- |
| C.HNO3=H++NO3- | D.K2SO4=2K++SO42- |
绿色植物是空气天然的“净化器”,研究发现,1平方米柳杉每月可以吸收16g SO2,则1平方米柳杉每月吸收的SO2的物质的量为
| A.5 mol | B.6.02×1023 | C.0.25 mol | D.0.25 g/mol |
下列变化中,必须加入氧化剂才能发生的是
| A.H2SO4 → SO2 | B.CO2→CO | C.Cl2→HCl | D.Na→NaCl |
下列各组离子能在溶液中大量共存的是
| A.K+、H+、SO42-、OH― | B.Na+、H+、CO32-、Cl- |
| C.Na+、Ca2+、NO3-、CO32- | D.Na+、K+、Cl―、SO42- |
铝片分别与①稀盐酸、②NaOH溶液反应,下列描述正确的是
| A.①中产生气泡,②中不产生气泡 |
| B.①和②中都不产生气泡 |
| C.①和②中都产生气泡,①中是H2,②中是O2 |
| D.①和②中都产生气泡,且都是H2 |
下列关于物质的用途,叙述不正确的是
| A.过氧化钠可用作供氧剂 | B.三氧化二铁可用做漆料 |
| C.镁铝合金可用作制造飞机的材料 | D.高纯硅用来制造光导纤维 |
浓硫酸是实验室必备的重要试剂,下列有关它的说法不正确的是
| A.具有强腐蚀性 | B.能用于干燥氨气 |
| C.能使蔗糖变黑 | D.加热时能与铜发生反应 |
下列关于CO的叙述不正确的是
| A.CO的摩尔质量28 g / mol |
| B.1mol CO中所含分子数为6.02×1023个 |
| C.1 mol CO的质量是28g |
| D.常温常压下,1 mol CO的体积为22.4 L |
某些粒子在化学反应中既能体现氧化性又能体现还原性,下列不属于此类的粒子的是
| A.Fe2+ | B.H2O2 | C.Mg | D.S |
下列离子方程式正确的是
A.Zn与稀H2SO4反应:Zn+2H+ Zn2++H2↑ Zn2++H2↑ |
| B.铁和稀硝酸反应:Fe+2H+=Fe2++H2↑ |
C.Cl2与NaOH溶液反应:Cl2+2OH― 2Cl―+H2O 2Cl―+H2O |
D.碳酸钙溶于盐酸:CO32—+ 2H+ CO2↑ + H2O CO2↑ + H2O |
下列试剂的保存方法中不正确的是
| A.少量的钠保存在煤油中 |
| B.浓硝酸保存在无色玻璃瓶中 |
| C.新制的氯水保存在棕色玻璃瓶中 |
| D.NaOH溶液保存在带橡皮塞的玻璃瓶中 |
欲配制100ml 1.0 mol/LNa2SO4溶液,正确的方法是
① 将14.2 g Na2SO4 溶于100ml水中
② 将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml
③ 将20 ml 5.0 mol/L Na2SO4溶液用蒸馏水稀释至100 ml
| A.①② | B.②③ | C.①③ | D.①②③ |
下列实验方法或操作能达到实验目的的是
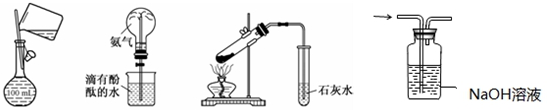
图1 图2 图3 图4
| A.图1:配制150 mL 0.1 mol/L盐酸 |
| B.图2:验证氨水呈碱性 |
| C.图3:探究NaHCO3的热稳定性 |
| D.图4:除去二氧化碳中的氯化氢 |
除去下列物质中的杂质(括号内为杂质),所选用的试剂不正确的一组是
| 选项 |
待提纯的物质 |
选用试剂 |
| A |
FeCl3溶液(FeCl2溶液) |
Cl2 |
| B |
NaCl溶液(Na2SO4溶液) |
Ba(NO3)2溶液 |
| C |
Cl2(HCl) |
饱和食盐水 |
| D |
CO2(SO2) |
酸性KMnO4溶液 |
设NA为阿伏加德罗常数的值,下列说法不正确的是
| A.物质的量浓度为1 mol/L的K2SO4溶液中,含2 mol K+ |
| B.把40 g NaOH固体溶于水得到1 L溶液,所得溶液中NaOH的物质的量浓度为1 mol·L-1 |
| C.常温常压下,71 g Cl2含有2 NA个Cl原子 |
| D.标准状况下,11.2 L N2中含有的电子数为7NA |
研究表明:海产品内含有对人体无害的+5价砷(As)元素,但砒霜的成分是As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜(富含维生素C),否则容易中毒,并给出了一个公式:大量海鲜+大量维生素C = 砒霜。下面有关解释不正确的是
A.维生素C能将+5价砷氧化成As2O3
B.维生素C具有还原性
C.同时大量食用海鲜和青菜过程中+5价砷发生还原反应
D.同时大量食用海鲜和青菜过程中维生素C被氧化
在氯水中存在多种分子和离子,它们在不同的现象中表现各自的性质。下列现象和结论一致且正确的是
| A.加入有色布条,有色布条褪色,说明溶液中有Cl2存在 |
| B.溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在 |
| C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在 |
| D.加入NaOH溶液,氯水黄绿色消失,说明有HClO |
已知:① 向KMnO4晶体滴加浓盐酸,产生黄绿色气体;② 向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;下列判断正确的为
| A.上述实验中,只有一个氧化还原反应 |
| B.实验①中 产物是Cl2和HMnO4 |
| C.实验①中浓盐酸不仅仅体现酸性 |
| D.实验②可证明Fe2+既有氧化性又有还原性 |
为了确定(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分,下列实验操作及叙述中正确的是
| A.取少量样品放入试管中,加热,试管口放一团蘸有无水硫酸铜粉末的棉花团,变蓝则可证明晶体的成分中一定含有结晶水 |
| B.取少量样品溶于水,向溶液中滴入几滴新制氯水,再滴入2滴KSCN溶液,溶液变为红色,则可证明晶体的成分中含有Fe2+ |
| C.取少量样品溶于水,滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
| D.取少量样品放入试管中,加入少量浓NaOH溶液并加热,在试管口用湿润的红色石蕊试纸检验,则可证明晶体的成分中是否含有NH4+ |
我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为:S+2KNO3+3C==K2S+N2↑+3CO2↑。该反应中,KNO3被 (填“氧化”或“还原”),该反应中的氧化剂是 ;若消耗1mol S,则生成 mol N2,这些N2的质量是 ,在标准状况下的体积是 。
①HCl、②过氧化钠、③碳酸氢钠、④二氧化硅是常见的物质。请回答下列问题。
(1)上述4种物质中属于盐的是 (填序号,下同);上述四种物质加入紫色石蕊溶液中,溶液变红的是 。
(2)写出HCl的电离方程式 。
(3)写出过氧化钠与水反应的化学方程式___________________________。
(4)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为______________。
(5)写出二氧化硅与氢氧化钠溶液反应的化学方程式_______________________。
氮及其化合物之间可以互相转化,请按照要求回答下列问题:
(1)实验室制取氨气。
① 实验室制取氨气的反应原理是利用了 类物质与 类物质的反应。
② 可用向下排空气法收集氨气的原因是 。
③ 用水吸收多余的氨气时,如将导管直接插入水中, 会产生倒吸现象,产生该现象的原因是 。
(2)完成下列能生成NO的化学方程式:
① 体现N元素的还原性:氨的催化氧化:____________。
② 体现N元素的氧化性:____________。
某小组同学采用以下装置验证SO2的性质:(夹持及加热装置略)
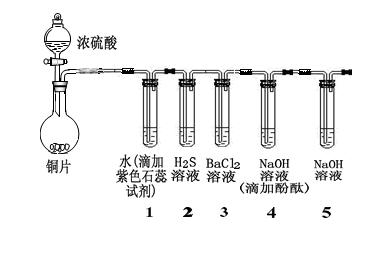
(1)写出圆底烧瓶中发生反应的化学方程式: 。
(2)从实验目的分析,试管1、4的目的都是为了证明SO2具有 (性质),试管2是为了证明SO2具有 (性质)。
(3)除上述两种性质外,你认为SO2还具有的性质是 ,可以通过加入 (填试剂化学式或者名称)加以证明。
(4)经过实验,观察到如下实验现象:
① 试管1中 。
② 试管2中有浅黄色浑浊出现,写出反应的化学方程式 。
(5)试管4中无明显现象,将其分成两份,分别加入下列物质均产生沉淀。将产生的沉淀的化学式填入下表相应位置。
| 加入的物质 |
O2 |
氨水 |
| 沉淀的化学式 |
|
|
(6)试管4和试管5均加入NaOH溶液,在实验目的上的不同点是 。
某化学小组欲探究FeCl3溶液、FeCl2溶液的化学性质
(1)试剂清单:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、碘化钾、淀粉溶液。
查阅资料得知:淀粉遇I2变蓝。
请帮助他们完成以下实验报告:
| 序号 |
实验 目的 |
实验内容 |
实验现象 |
实验结论 |
离子方程式 |
| 实验1 |
① |
在FeCl2溶液中滴入适量 氯水 |
溶液由浅绿色 变为黄色 |
② |
③ |
| 实验2 |
④ |
在FeCl2溶液中加入锌片 |
 |
⑤ |
Zn +Fe2+= Zn2++Fe |
| 实验3 |
⑥ |
在FeCl3溶液中加入足量 铁粉 |
⑦ |
FeCl3(Fe3+)具有氧化性 |
⑧ |
| 实验4 |
⑨ |
在FeCl3溶液中滴入适量KI溶液和 淀粉溶液 |
淀粉溶液变蓝 |
⑩ |
2Fe3++2I-=2Fe2++I2 |
填空:
① ③ ⑤
⑧ ⑩
综合以上实验,你能得到的结论是: 。
(2)除了以上性质,你认为FeCl2还可能具有的性质是:(用离子方程式表示,任写一个即可) 。
(3)亚铁盐在溶液中易被氧化,而实验中需要纯净的亚铁盐溶液。保存亚铁盐溶液时如何防止亚铁盐被氧化 。
(4)检验某溶液是Fe2+溶液的方法是(任写一种试剂及其对应的现象即可): 。
(5)某同学向FeCl2中加入NaClO溶液,产生红褐色沉淀,你认为该反应中产生红褐色沉淀的原因可能是 。