中华民族有着光辉灿烂的发明史,下列发明创造不涉及化学反应的是
| A.用蚕丝织丝绸 | B.粮食酿酒 | C.湿法炼铜 | D.人工合成青蒿素 |
下列物质组别,不属于同素异形体的是
| A.石墨和石墨烯 | B.O2和O3 | C.H2O和H2O2 | D.单斜硫和斜方硫 |
实验室里需储存在棕色试剂瓶中的是
A.金属钠 B浓硝酸 C.FeSO4溶液 D.浓硫酸
下列物质属于非电解质的是
| A.氯气 | B.醋酸 | C.氨气 | D.氯化钠溶液 |
下列有关硫及其化合物的叙述正确的是
| A.硫单质是一种淡黄色易溶于水的固体 | B.SO2的漂白原理与活性炭相同 |
| C.可用澄清石灰水鉴别SO2和CO2 | D.可用铁质或铝质容器储存浓硫酸 |
下列事实与胶体性质无关的是
| A.豆浆中加入CaSO4制豆腐 |
| B.清晨在茂密的森林里看到缕缕阳光穿过林木枝叶 |
| C.FeCl3溶液中加入NaOH溶液产生红褐色沉淀 |
| D.使用钢笔时不宜将不同品牌的墨水混用 |
下列有关物质分类的正确组合是
| 分类 组合 |
碱 |
酸 |
盐 |
碱性氧化物 |
酸性氧化物 |
| A |
Na2CO3 |
H2SO4 |
NaHCO3 |
Fe2O3 |
CO2 |
| B |
NaOH |
NaHSO4 |
NH4Cl |
Na2O |
NO2 |
| C |
KOH |
CH3COOH |
NaClO |
Na2O2 |
SO2 |
| D |
NH3•H2O |
HNO3 |
CaCO3 |
CaO |
SO3 |
下列化学反应中,属于氧化还原反应的是
| A.SO2+2NaOH=Na2SO3+H2O | B.SiH4+2H2O+8AgNO3=8Ag↓+SiO2↓+8HNO3 |
| C.Na2O+H2O=2NaOH | D.Al(OH)3+NaOH=Na[Al(OH)4] |
下列有关自然界中氮循环(如右图)的说法不正确的是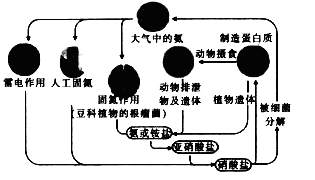
A.含氮无机物和含氮有机物可相互转化
B.通过闪电产生NO属于高能固氮
C.硝酸盐被细菌分解为氮气过程,氮元素一定被氧化
D.C、H、O也参与自然界中氮循环
下列变化需加入氧化剂才可实现的是
| A.CO→CO2 | B.CO2→Na2CO3 | C.NO2→HNO3 | D.S→CuS |
下列铁的化合物不可能由化合反应直接制得的是
| A.FeCl2 | B.Fe2(SO4)3 | C.FeCl3 | D.FeS |
在溶液中能大量共存的一组离子是
| A.K+、H+、ClO-、CO32- | B.NH4+、K+、OH-、NO3- |
| C.H+、Mg2+、MnO4-、SO42- | D.Fe3+、Na+、I-、Cl- |
下列反应的离子方程式正确的是
| A.Ba(OH)2溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ |
| B.CaCO3与醋酸反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C.NaHCO3溶液与NaOH溶液反应:HCO3-+OH=CO32-+H2O |
| D.Cu与FeCl3溶液反应:Cu+Fe3+=Cu2++Fe2+ |
为检验某溶液中的离子,下列操作方法及结论正确的是
| A.加入氯水,再加入KSCN溶液,溶液显红色,则溶液中一定含有Fe2+ |
| B.加入盐酸,产生无色无味且能使澄清石灰水变浑浊的气体,则溶液中一定含有CO32- |
| C.加入Ba(NO3)2溶液,再加入稀盐酸,产生白色沉淀,则溶液中一定含有SO42- |
| D.加入NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则溶液中一定含有NH4+ |
根据右图转化关系判断下列说法不正确的是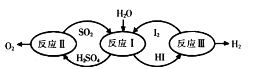
| A.反应Ι中SO2是还原剂 |
| B.反应Ш中H2是还原产物 |
| C.氧化性强弱顺序是:H2SO4>I2>SO2 |
| D.该转化关系可实现分解H2O制取H2 |
中学化学常见物质存在转化关系:A+B→C+D+H2O,其中C属于盐类,下列推断不正确的是
| A.若A为黄绿色气体,则D可能有漂白性 |
| B.若A为红色金属单质,则D一定是红棕色气体 |
| C.若A为纯碱,则D一定能使澄清石灰水变浑浊 |
| D.若A为氯化铵,则D一定是具有刺激性气味的气体 |
用化学用语表达下列变化过程,其中(1)~(3)写化学方程式,(4)~(5)写离子方程式。
(1)金属钠与水反应______________________
(2)工业合成氨____________________________
(3)二氧化硫与硫化氢反应___________________________
(4)碳酸氢钠溶液与稀盐酸反应_______________________
(5)少量氯气通入碘化钾溶液中_______________________
Na2O2可作为潜水艇里氧气的来源。将3.9gNa2O2充分反应。
(1)Na2O2的物质的量为_________mol。
(2)生成的O2在标准状况下的体积为___________L。
(3)反应中转移的电子数为________(NA为阿伏加德罗常数的值)。
实验室用MnO2粉末与浓盐酸共热制取氯气:
MnO2+4HCl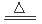 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
实验Ι 验证氯气能否与水反应
某同学设计了如下图所示的实验装置:
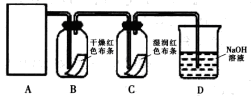
(1)从下图选择适合A处的装置__________(填序号)。
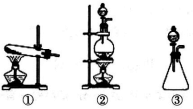
(2)装置B中能否观察到预期的实验现象?_________(填“能”或“不能”),请说明理由______________。
实验II 测定反应后A中残余盐酸的浓度
步骤一:配制100mL1.00mol∙L-1的NaOH溶液,配制过程如下:
①称量_______gNaOH固体,在烧杯中用适量蒸馏水溶解,冷却。
②将烧杯中的溶液转移至________中,并用少量蒸馏水洗涤烧杯内壁及玻璃棒2~3次,洗涤液也注入容量瓶中。
③继续加蒸馏水至离刻度线1~2cm处,改用_________滴加蒸馏水至凹槽面最低处与刻度线相切。
④盖上瓶塞,上下颠倒摇匀,将所配溶液转移至指定试剂瓶中,贴上标签。
步骤二:取2.00mL反应后A中的溶液,稀释后滴加步骤一配制所得NaOH溶液,恰好完全反应时,消耗NaOH溶液的体积为11.80mL。
(3)完成步骤一的空格。
(4)根据实验数据,计算反应后A中残余盐酸的浓度为_________mol∙L-1。
(5)某同学欲通过测Cl-浓度来推测反应后A中残余盐酸的浓度,取2.00mL反应后A中的溶液,加入2.00mol∙L-1AgNO3溶液至不再产生沉淀时,发现所加的AgNO3溶液的体积远大于理论值5.80mL,其原因是____________。
中学化学常见物质A、B、C、D、X、Y,存在如下图转化关系(部分物质和条件略去)
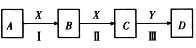
(1)若A为NaOH溶液,X为CO2,D是沉淀,则Y可为___________(填序号)。
A.SO3 B.Ba(OH)2 C.H2SO4 D.CaO
(2)若A为黄铁矿(FeS2),D是H2SO4,则反应Ⅱ的化学方程式为_________________________。
(3)若A为碱性气体,A与D反应生成一种化肥,则反应Ⅲ的化学方程式为__________________。
(4)若A和X均为单质,反应Ⅲ的现象是白色沉淀,在空气中迅速变成灰绿色,最后变成红褐色,则反应II的离子方程式为__________________________。
浓硫酸具有强氧化性可将红磷氧化为磷酸,其反应原理是
2P+5H2SO4(浓)==2H3PO4+5SO2↑+2H2O
若有1.24g的红磷参加反应,则:
(1)标出该反应的电子转移方向及数目。
(2)计算生成的SO2在标准状况下的体积。(写出计算过程)
下列离子能满足相应要求的是
| 选项 |
离子组 |
要求 |
| A |
K+、CO32-、SO42-、Cl- |
c(K+)<c(Cl-) |
| B |
Na+、CO32-、NO3-、I- |
滴加盐酸立刻有气体生成 |
| C |
Mg2+、Cl-、Na+、SO42- |
滴加氨水立刻有沉淀生成 |
| D |
NH4+、SO42-、Na+、H+ |
滴加烧碱溶液立刻有气体生成 |
NA为阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,3.36L氧气与3.2g硫反应,生成SO2分子数为0.1NA |
| B.1L0.1mol∙L-1氨水中NH3∙H2O分子数为0.1NA |
| C.标准状况下,1.12LCl2发生反应转移的电子数一定为0.1NA |
| D.10g46%酒精(C2H5OH)中含氧原子总数为0.1NA |
利用右图装置进行下列实验,不能得出相关实验现象的是
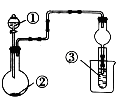
| 选项 |
① |
② |
③ |
④ |
| A |
浓盐酸 |
Na2SO3 |
BaCl2溶液 |
出现浑浊 |
| B |
稀盐酸 |
石灰石 |
饱和Na2CO3溶液 |
出现浑浊 |
| C |
浓氨水 |
生石灰 |
酚酞溶液 |
出现红色 |
| D |
醋酸 |
贝壳 |
澄清石灰水 |
先浑浊后澄清 |
向FeCl3、CuCl2混合溶液中通入H2S和O2的混合气体可回收S,其转化关系如右图。相关说法不正确的是
| A.反应I的基本反应类型是复分解反应 |
| B.反应II中每生成1molS需要2molFeCl3 |
| C.在转化过程中能循环利用的物质有FeCl2和CuCl2 |
| D.在转化过程中化合价不变的元素只有Cu和Cl |
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+和K+。取该溶液100mL,加入过量NaOH溶液并加热,得到0.02mol气体,同时产生红褐色沉淀,将过滤洗涤后的沉淀灼烧得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。下列说法正确的是
| A.该溶液中最多存在4种离子 |
| B.该溶液中不能确定是否存在CO32- |
| C.该溶液中一定存在Cl-、且c(Cl-)≥0.4mol∙L-1 |
| D.该溶液可由KCl、(NH4)2SO4和FeCl3配制而成 |
烟气中主要污染物为SO2、NO、NO2,可用如下工艺进行脱硫脱硝及产物回收。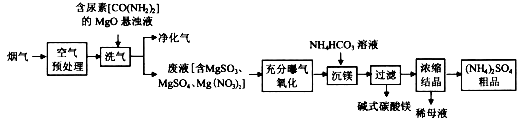
(1)空气预处理过程中,发生主要反应的化学方程式为____________________________。
(2)洗气过程中,尿素作还原剂,转化成两种无污染的气体是_________________(填化学式)。
(3)充分曝气氧化过程中,发生反应的化学方程式为___________________。
(4)完成沉镁过程中生成碱式碳酸镁[MgCO3∙Mg(OH)2]的离子方程式
______Mg2++______= MgCO3∙Mg(OH)2↓+______CO2↑+______H2O
(5)(NH4)2SO4粗品中含有的主要杂质为__________(填名称)。
(6)碱式碳酸镁经过简单加工可循环利用,加工过程发生反应的化学方程式为________________。
为探究铁和稀硝酸反应的产物,某兴趣小组进行如下实验。
查阅资料
i.NO+Fe(NO)SO4(棕色)
ii.KMnO4溶液可氧化吸收NO和NO2
iii.0.2mol∙L-1NaOH溶液可完全吸收NO、NO2混合气体中的NO2,而不吸收NO
实验Ⅰ 用以下装置验证铁和过量12mol∙L-1硝酸反应产生的气体中含有NO

(1)图1的A装置中加入硝酸前需加入N2一段时间的目的是______________。
(2)通N2一段时间后,加入12mol∙L-1硝酸后看到A装置中产生红棕色气体,B装置中溶液变棕色。根据实验现象不能确定产生的气体中含有NO,理由是_______________。请在图1装置的基础上提出改进措施______________________。
(3)用图1的A装置和图2装置可测量反应产生的NO体积,实验操作如下
a.连接装置,并检查气密性
b.往A装置中加入铁片后,再往分液漏斗加入12mol∙L-1的硝酸
c.通N2一段时间后关闭
d.向水槽中加入0.2 mol∙L-1NaOH溶液
e.打开分液漏斗活塞,加入一定量12 mol∙L-1硝酸后,关闭活塞
f.将装满0.2 mol∙L-1NaOH溶液的量筒倒扣在水槽中
g.待反应装置恢复至室温时,读取数据
①操作的正确顺序是a→b→______→______→______→______→g
②读取数据时应注意__________________。
实验Ⅱ 对4mol∙L-1硝酸与过量铁反应的产物进行探究
反应过程中溶液中c(H+)和产生气体的体积(标准状况下)随铁的消耗量变化关系如下图所示。
(4)据图推测HNO3在bc段的还原产物是_________(填化学式);若在ab段只产生单一的气体,则该气体是________(填化学式)。
