下列说法正确的是
| A.呈酸性的雨水就是酸雨 | B.“雷雨肥庄稼”符合科学道理 |
| C.雾和雾霾都属于气溶胶 | D.白色物质引起的污染叫白色污染 |
下列有关物质的用途错误的是
| A.水玻璃可用作木材防火剂 |
| B.二氧化硅是制造光导纤维的材料 |
| C.石英是制造太阳能电池的常用材料 |
| D.石灰石和纯碱均是生产普通玻璃的原料 |
下列物质属于电解质的是
| A.硫酸氢钠 | B.铜 | C.氯气 | D.氨 |
下列说法正确的是
| A.能电离出H+的物质属于酸 |
| B.盐类物质中一定含有金属离子 |
| C.过氧化氢与二氧化硫的漂白原理相同 |
| D.胶体与其它分散系的本质区别是分散质粒子直径的不同 |
下列有关概念间关系的说法正确的是
| A.碱性氧化物一定是金属氧化物 |
| B.氧化剂在化学反应中一定被氧化 |
| C.酸性氧化物一定是非金属氧化物 |
| D.摩尔质量相同的物质其摩尔体积一定相同 |
下列实验方案设计中,可行的是
| A.用萃取的方法可将汽油和煤油进行分离 |
| B.加过量稀盐酸后过滤,可除去混在铜粉中的少量镁粉和铝粉 |
| C.用溶解、过滤的方法可分离硝酸钾和氯化钠固体混合物 |
| D.将混有氢气的氧气通过灼热的氧化铜,以除去其中的氢气 |
下列情况会对人体健康造成较大危害的是
| A.用SO2漂白食品 |
| B.自来水中通入少量Cl2进行消毒杀菌 |
| C.用小苏打(NaHCO3)发酵面团制作馒头 |
| D.用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) |
下列各组物质,按化合物、单质、混合物顺序排列的是
| A.干冰、 铁、 冰水 | B.烧碱、液态氧、氯水 |
| C.生石灰、白磷、熟石灰 | D.黄铜、氮气、胆矾 |
下列各组中的离子,能在溶液中大量共存的是
| A.Ba2+、Na+、Cl-、SO42- | B.Ag+ 、Al3+ 、NO3- 、H+ |
| C.Na+、HCO3-、Cl-、OH- | D.K+ 、H+ 、SO42-、OH- |
下列有关物质存放方法错误的是
| A.金属钠存放于煤油中 |
| B.漂白粉长期放置在烧杯中 |
| C.铝片长期放置在不密封的纸盒里 |
| D.FeSO4溶液存放在加有少量铁粉的试剂瓶中 |
下列化学方程式中,不能用H++OH-=H2O表示的是
| A.KOH+HCl=KCl+H2O | B.2NaOH+H2SO4=Na2SO4+2H2O |
| C.Ba(OH)2+2HCl=BaCl2+2H2O | D.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O |
下列关于碳酸钠和碳酸氢钠的说法不正确的是
| A.碳酸钠的热稳定性比碳酸氢钠强 |
| B.相同温度时,碳酸钠的溶解度大于碳酸氢钠 |
| C.同温度、同物质的量浓度时,碳酸钠溶液碱性大于碳酸氢钠溶液 |
| D.碳酸氢钠一定条件下可转化为碳酸钠,但碳酸钠不能转化为碳酸氢钠 |
已知反应:Na2O2 + SO2 = Na2SO4,则下列判断正确的是
| A.硫元素被还原 |
| B.二氧化硫是还原剂 |
| C.过氧化钠既是氧化剂又是还原剂 |
| D.二氧化硫既不是氧化剂也不是还原剂 |
下列有关离子检验的方法正确的是
| A.某溶液中加入硝酸银溶液,产生白色沉淀,该溶液中一定含有Cl- |
| B.某溶液中加入氢氧化钠溶液立即有白色沉淀产生,该溶液中一定有Al3+ |
| C.某溶液中加入稀盐酸,产生使澄清石灰水变浑浊的气体,该溶液中一定含有CO32- |
| D.某溶液中加入稀盐酸无现象,加入氯化钡溶液有白色溶液产生,该溶液中一定有SO42- |
一定量的浓硝酸与过量的铜充分反应,生成的气体是
| A.只有NO2 | B.只有NO | C.NO2和NO | D.NO2和H2 |
必须通过加入其它试剂才能鉴别的一组无色溶液是
| A.氯化铝溶液和氢氧化钾溶液 | B.碳酸氢钠和稀盐酸 |
| C.偏铝酸钠溶液和稀硝酸 | D.碳酸钠和稀硫酸 |
下列所给粒子间的数量满足2:1关系的是
| A.氧化钠中的氧离子和钠离子 |
| B.二氧化硅中的硅原子和氧原子 |
| C.过氧化钠中的钠离子和过氧根离子 |
| D.碳酸溶液中的氢离子和碳酸根离子 |
相同质量的铝分别与足量的稀盐酸和氢氧化钠溶液反应,下列说法不正确的是
| A.相同条件下,产生气体的体积相等 |
| B.生成的铝的化合物的物质的量相等 |
| C.消耗酸和碱的物质的量相等 |
| D.相同条件下,转移的电子数相等 |
(8分)(1) 0.5 mol SO2共约含有 个原子,它与 gSO3所含硫原子数相等。
(2)质量相同的 ①HCl、②NH3、③CO2、④O2四种气体中,含有分子数目最少的是(填序号) _ 。
(3)有100mL 0.2 mol/L 的NaOH溶液,将此溶液稀释到200 mL,则溶液中Na+的物质的量是 。
(8分) 洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一,漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为 。
(2)漂白粉的有效成分是(填化学式) 。
(3)漂白粉溶于水后,受空气中的CO2作用,即有漂白、杀菌的性能,其原理是(用化学反应方程式表示) 。
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号) 。
(10分)(1)向用氯化铁溶液刻制印刷电路后的废液中,加入足量铁粉,发生反应的离子方程式是 、 。
(2)实验室向某溶液中加入硫氰化钾溶液,无现象,滴加少量氯水,立即变为红色,则原溶液中含有(填离子符号) ,写出滴加氯水时发生反应的离子方程式 。
(3)我们知道,浓硫酸有脱水性、吸水性和氧化性,请写出证明浓硫酸具有氧化性的反应的化学方程式(写一个,多写若有一个错误,本题不得分) 。
用NaCl固体配制1mol/L的NaCl溶液100mL。
(1)实验室有下列仪器:①玻璃棒;②胶头滴管;③100mL量筒;④100mL容量瓶;⑤250mL量筒;⑥托盘天平;⑦50mL烧杯;应选用的仪器(填编号) 。
(2)应称取NaCl的质量为 。
(3)在定容时,不小心滴加的蒸馏水超过了刻度线,处理的方法是 ;将NaCl溶液转移到容量瓶后,未对烧杯和玻璃棒进行洗涤,则所得溶液的浓度(填“偏高”或“偏低”或“不变”) 。
(12分)实验室可用干燥纯净的氨还原氧化铜来制取氮气。根据下列装置图(部分夹持装置略去)回答有关问题: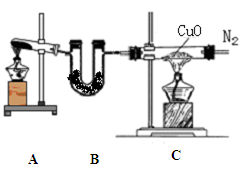
(1)装置B中盛放的药品是 。
(2)写出装置A中反应的化学方程式______ 。
(3)写出装置C中反应的化学方程式_________,该反应中的氧化剂是 。
(4)收集到的氮气中除了含有少量水蒸气外,还可能含有另外一种气体,确定是否含有该气体的实验方法是 ,实验室收集氮气的方法是 。
(4分)除杂(括号内为杂质)
| 序号 |
物质 |
除杂试剂 |
| (1) |
CO2(HCl) |
|
| (2) |
Fe2O3(Al2O3) |
|
| (3) |
NaCl溶液(MgCl2) |
|
| (4) |
NO气体(NO2) |
|
(6分) 向1L AlCl3和FeCl3混合溶液中加入2mol /LNaOH溶液300mL时,产生的沉淀量达最大值;继续加入NaOH溶液,沉淀开始溶解,当加入NaOH溶液的总体积达到 350mL时,沉淀不再减少,求原溶液中FeCl3的物质的量浓度(需写出解题过程)。