现有五种离子化合物A、B、C、D和E,都是由下表中离子形成的:
| 阳离子 |
Na+ H+ Ba2+ |
| 阴离子 |
OH– CO32– SO42– |
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体,少量的该气体可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于B溶液;
请根据上述实验结果,填空:
(1)写出化合物的化学式: B:__________;C:__________;
(2)现有A、B、C三种物质的量浓度与体积都相等的溶液,若以不同顺序将它们中的两种混合起来,
如果出现沉淀则过滤,再将滤液与第三种溶液混合起来,最终所得的溶液 (填“可能”或
“不可能”)为酸性。写出最终所得的溶液碱性的混合顺序 。
下图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mole—,若不考虑溶液体积的变化,下列叙述正确的是
| A.产生气体体积①=② |
| B.电极上析出固体质量①<② |
| C.电极反应式:①中阳极:4OH-—4e-=2H2O+O2↑②中负极2H++2e-=H2↑ |
| D.溶液的pH变化:①减小②增大 |
一定条件下的反应:PCl5(g)  PCl3(g)+Cl2(g)(△H>0)达到平衡后,下列情况使PCl5分解率降低的是
PCl3(g)+Cl2(g)(△H>0)达到平衡后,下列情况使PCl5分解率降低的是
| A.温度、体积不变,充入氩气 | B.体积不变,对体系加热 |
| C.温度、体积不变,充入氯气 | D.温度不变,增大容器体积 |
把0.6 mol X气体和0.4 mol Y气体混合于容积为2 L的容器中,使其发生反应3X(g)+Y(g)===nZ(g)+2W(g)。5 min末生成0.2 mol W,若测知0~5 min内以Z的浓度变化表示的平均反应速率为0.01 mol/(L·min),则n的值为
| A.1 | B.2 | C.3 | D.4 |
有关下图装置的叙述不正确的是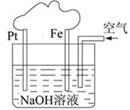
| A.这是电解NaOH溶液的装置 |
B.该装置中Pt为正极,电极反应为:O2+ 2H2O + 4e- 4OH- 4OH- |
| C.该装置中Fe为负极,电极反应为:Fe—2e—=Fe2+ |
| D.溶液中最终产生红褐色沉淀 |
已知反应A2(g)+2B2(g) 2AB2(g)△H <0,下列说法正确的
2AB2(g)△H <0,下列说法正确的
| A.升高温度,正向反应速率增加,逆向反应速率减小 |
| B.升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
| D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |