某反应体系中的物质有:MnSO4、K2S2O8(过硫酸钾)、KMnO4、K2SO4、H2SO4。已知K2S2O8的氧化性比KMnO4强。下列有关的说法正确的是 ( )
| A.配平该反应后K2S2O8与K2SO4的计量系数之比为5:3 |
| B.此反应的还原剂与H2SO4之比为1:5 |
| C.此反应的还原剂K2SO4和H2SO4 |
| D.5mol参与此反应氧化剂的,电子转移数目为10mol |
NA为阿伏加德罗常数,下列有关说法中不正确的是
| A.标准状况下,22.4 L氦气含有NA个氦原子 |
| B.20 g重水含有10 NA个电子 |
| C.12.5 mL l6 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2 NA |
| D.1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1 NA |
下列各组离子中,在溶液中能大量共存,加入氢氧化钠溶液有沉淀析出,加入稀盐酸有气体放出的是
| A.Na+、Ca2+、SO42―、CO32― | B.K+、Ba2+、HCO3―、Cl― |
| C.K+、Al3+、SO42―、NO3― | D.K+、Na+、CO32―、SO42― |
下列解释事实的离子方程式正确的是
A.铁和稀硝酸反应制得浅绿色溶液:Fe+ 4H+ + NO3- Fe3+ + NO↑+ 2H2O Fe3+ + NO↑+ 2H2O |
B.实验室盛碱液的瓶子不用玻璃塞:SiO2 + 2OH-  SiO32-+ H2O SiO32-+ H2O |
C.用稀盐酸和大理石反应制取CO2:CO32- + 2H+  CO2↑ + H2O CO2↑ + H2O |
D.向Ca(ClO)2溶液中通入过量CO2制取次氯酸: 2ClO-+ H2O + CO2 2HClO + CO32- 2HClO + CO32- |
铁氧体(Fe3O4)法是处理含铬废水的常用方法.其原理是:用FeSO4把废水中Cr2O72-还原为Cr3+,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4或Fe2O3·FeO)的复合氧化物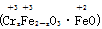 。 处理含1 mol Cr2O72-废水至少需要加入a mol FeSO4·7H2O。下列结论正确的是
。 处理含1 mol Cr2O72-废水至少需要加入a mol FeSO4·7H2O。下列结论正确的是
| A.x=1,a=5 | B.x=0.5,a=8 |
| C.x=2,a=10 | D.x=0.5,a=10 |
将一定量的SO2通入Ca(ClO)2溶液中,下列反应的离子方程式一定错误的是
| A.SO2+H2O+Ca2++2ClO-====CaSO3↓+2HClO |
| B.SO2+H2O+Ca2++2ClO-====CaSO4↓+HClO+H++Cl- |
C.2SO2+2H2O+Ca2++2ClO-====CaSO4↓+4H++2Cl-+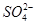 |
| D.SO2+H2O+Ca2++3ClO-====CaSO4↓+2HClO+Cl- |