根据下表提供的材料,下列叙述中,正确的是 ( )
| 序号 |
氧化剂 |
还原剂 |
其他反应物 |
氧化产物 |
还原产物 |
| ① |
Cl2 |
FeBr2 |
|
|
FeCl2 |
| ② |
KMnO4 |
H2O2 |
H2SO4 |
O2 |
MnSO4 |
| ③ |
KClO3 |
HCl(浓) |
|
Cl2 |
Cl2 |
| ④ |
KMnO4 |
HCl(浓) |
|
Cl2 |
MnCl2 |
| A.表中第①组反应的氧化产物只有FeCl3(实为Fe3+) |
| B.氧化性比较:KMnO4>Cl2>Fe3+>Br2>Fe2+ |
| C.表中第③组反应的氧化产物与还原产物的质量之比为6:1 |
| D.④的离子方程式配平后,H+的化学计量数应为16 |
下列实验操作正确的是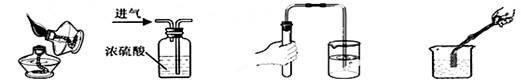
| A.点燃酒精灯 | B.干燥氢气 | C.检查气密性 | D.测定溶液的pH |
“无土栽培”是一项利用化学试剂配成的营养液来栽培植物的新技术.下列是某营养液所含的主要成分,其中属于复合肥料的是
| A.KNO3 | B.CO(NH2)2 | C.Ca(H2PO4)2 | D.(NH4)2SO4 |
依据国家相关法律规定,机动车驾驶员醉驾将受到刑事处罚。检测驾驶员是否酒后驾车,可用一种装有重铬酸钾(K2Cr2O7)的仪器。在K2Cr2O7中Cr元素的化合价是
| A.+2 | B.+3 | C.+6 | D.+7 |
漂白粉的有效成分是
| A.次氯酸钙 | B.氯化钙 |
| C.次氯酸 | D.次氯酸钙与氯化钙 |
实验室配制1mol/L 250mL NaCl溶液,下列仪器中不需要的是
| A.玻璃棒 | B.分液漏斗 | C.胶头滴管 | D.250mL容量瓶 |