下列叙述正确的是
A.危险化学品标志中的数字表示该危险品的危害程度,数字越大危害越大 |
B.二氧化硅晶体被广泛用于制作太阳能电池和光导纤维 |
C.根据分散质在分散剂中均匀分布时间的长短把分散系进一步分为溶液、胶体和浊液 |
D.钢材和硬币都是合金,若改变这些合金的原料配比会改变这些合金的性能 |
短周期原子序数依次增大的主族元素R、T、Q、W、Y具有如下信息:
① R、Y原子的最外层电子数与电子层数相同;
② Q是地壳中含量最高的元素,R与T的核电荷数之和等于Q的核电荷数;
③ W与R同主族。下列说法正确的是
| A.元素Q与W形成的两种常见化合物中含有相同比例的阴、阳离子,属于同种晶体类型 |
| B.元素T、Q、W、Y的原子半径大小为:T<Q<Y<W |
| C.Q与Y组成的常见物质是一种两性物质,结构中含有共价键 |
| D.由Y和T组成的物质YT是原子晶体,在电子和陶瓷工业上有广泛应用,可以直接由单质Y和T在低温下合成 |
2013年7月23日,央视记者分别在北京崇文门附近的麦当劳、肯德基以及真功夫3家大型快餐店取回可食用冰块进行抽样检测。检测结果显示:3家快餐店食用冰块菌落总数严重超标。下列说法正确的是
| A.肉毒杆菌有毒,可在其中加入硫酸铜使其变性后食用 |
| B.肉毒杆菌在体内水解生成的氨基酸不能成为人体重要的营养物质 |
| C.大肠杆菌分子中不一定含羧基和氨基 |
| D.出血性大肠杆菌和油脂均为能水解的高分子化合物 |
在100mL密度为1.2g/mL稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有NO),向反应后溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀质量比原金属质量增加5.1g。则下列叙述不正确是
| A.当金属全部溶解时收集到NO气体的体积为2.24L(标准状况) |
| B.当生成沉淀的量最多时,消耗NaOH溶液体积最小为100mL |
| C.原稀硝酸的物质的量浓度一定为4 mol/L |
| D.参加反应金属总质量(m)为9.6g>m>3.6g |
下列有关说法正确的是
A.已知:HI(g) 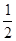 H2(g)+ H2(g)+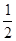 I2(s) △H =-26.5kJ/mol,由此可知1mol HI气体在密闭容器中充分分解后可以放出26.5kJ的热量 I2(s) △H =-26.5kJ/mol,由此可知1mol HI气体在密闭容器中充分分解后可以放出26.5kJ的热量 |
| B.已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol,则氢气的燃烧热为ΔH=-285.8 kJ/mol |
| C.肼(N2H4)是一种用于火箭或燃料电池的原料,已知 2H2O(g)+ O2(g)=2H2O2(l)△H=+108.3kJ/mol① N2H4(l) + O2(g)=N2(g) + 2H2O(g)△H=-534.0kJ/mol② 则有反应:N2H4(l) + 2 H2O2(l) =N2(g)+ 4H2O(l)△H=-642.3kJ/mol |
| D.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq) = CH3COONa(aq)+H2O(l)ΔH=-57.4 kJ/mol |
下列各项中“操作或现象”能达到预期“实验目的”的是
| 选项 |
目 的 |
操作或现象 |
| A |
制备无水FeCl3 |
将FeCl3溶液加热蒸干 |
| B |
除去KNO3中少量NaCl |
将混合物制成热的饱和溶液,冷却结晶,过滤 |
| C |
证明非金属性Cl>C>Si |
向碳酸钠溶液中加盐酸产生气体,将气体先通过饱和NaHCO3溶液,再通入硅酸钠溶液时产生白色沉淀 |
| D |
测定NaCl中混有Na2CO3的量 |
取一定量样品加入足量稀硫酸,将产生的气体直接用足量碱石灰吸收,测得其增重,便可求得原样品中Na2CO3的量 |