某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,设计了如下图所示的实验装置,试按要求回答问题。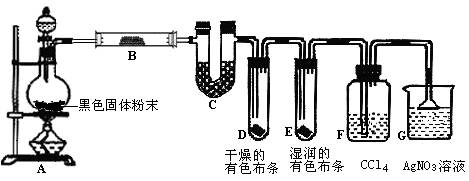
(1)写出装置A中反应的离子方程式_______________________________________;
(2)①装置B中盛放的试剂名称为 ,装置C的作用是 ;
②装置D和E中出现的不同现象说明的问题是 ;
(3)F装置的作用是 ;
(4)若装置G中出现白色沉淀,该实验现象能否说明A中制备出的Cl2中含有HCl气体
(填“能”或“不能”)。
(13分) 下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。
(已知:2Al + 3FeO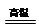 3Fe + Al2O3;2
3Fe + Al2O3;2 Al + Fe2O3
Al + Fe2O3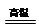 2Fe + Al2O3;
2Fe + Al2O3;
8Al + 3Fe3O4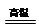 9Fe + 4Al2O3)
9Fe + 4Al2O3)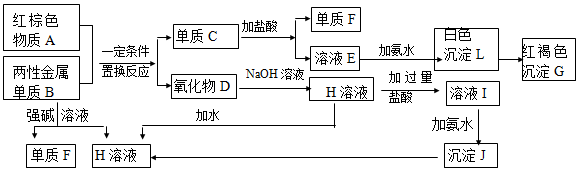
(1)化合物A的化学式是,写出物质A的一种用途。
(2)写出单质B与强碱溶液反应的离子方程式。
(3)写出由沉淀J生成 H溶液的离子方程式 。
。
(4)溶液E中加入氨水时,先生成白色沉淀L,写出生成L的离子方程式。
白色沉淀L会迅速变为 色,最终变为红褐色沉淀G,写出L变为G的化学反应方程式。
色,最终变为红褐色沉淀G,写出L变为G的化学反应方程式。
(5)溶液I中所含金属离子是_____________________。
(17分) 现有下列十种物质:
①H2②铝③CaO④CO2⑤H2SO4⑥Ba(OH)2
⑦红褐色的氢氧化铁液体⑧氨水⑨稀硝酸⑩Al2(SO4)3
(1)上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 分类标准 |
金属单质 |
氧化物 |
溶液 |
胶体 |
电解质 |
| 属于该类的物质 |
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-= H2O,该离子反应对应的化学方程 式为__________________________________________________________。
式为__________________________________________________________。
(3)⑩在水中的电离方程式为__________________________________________________,
(4)少量的④通入⑥的溶液中反应的离子方程式为________________________________。
(5)②与⑨发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,该反应的氧化剂是____________(填化学式),氧化剂与还原剂的物质的量之比是_____________,当有5.4g Al发生反应时,转移电子的物质的量为_________________。该反应的离子方程式为___________________________________________________。
(10分) 按要求填空
(1)配平下列化学方程式:并用单线桥标出电子转移的方向和数目。
______Fe3O4 + ______CO = _____Fe+_______CO2
(2)检验SO42-所需要用的试剂__________________和___ _______________。
_______________。
(3)三硅酸镁(Mg2Si3O8·11H2O)用氧化物表示_______________________。
(4)0.3 mol NH3分子中所含质子数与________个H2O分子中所含质子数相等。
研究NO2、SO2 、等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为。利用反应6NO2+ 8NH3 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是L 。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是L 。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH =" -" 196.6 kJ· mol-1
2SO3(g) ΔH =" -" 196.6 kJ· mol-1
2NO(g)+O2(g) 2NO2(g) ΔH =" -" 113.0 kJ· mol-1
2NO2(g) ΔH =" -" 113.0 kJ· mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH =kJ· mol-1。
SO3(g)+NO(g)的ΔH =kJ· mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=。
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1molSO2(g)
氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(1)图中A、C分别表示、,E的大小对该反应的反应热有无影响?。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是;
(2)图中△H =KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,身被还原为四价钒化合物;四价钒化合物
再被氧气氧化。写出该催化循环机理的化学方程式;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)=mol·L-1·min-1、υ(SO3)=mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 KJ·mol-1,则由S(s)生成3 molSO3(g)的△H = 。