将ag氯化钾溶于1.8 L水中,恰好使k+离子数与水分子数之比为1:100,则a值为
( )
| A.0.745 | B.0.39 | C.39 | D.74.5 |
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g) CH3OH(g)ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右下图所示。下列说法正确的是( )
CH3OH(g)ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如右下图所示。下列说法正确的是( )

草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH)="=" 0时,c(H+,W)="=" 1 × 10-2 mol/L |
B.V(NaOH)< 10 mL时,不可能存在c(Na+)="=" 2 c(C2O )+ c(HC2O )+ c(HC2O ) ) |
| C.V(NaOH)="=" 10 mL时,c(H+,W)="=" 1 × 10-7mol/L |
D.V(NaOH)> 10 mL时,c(Na+)> c(C2O )>c(HC2O )>c(HC2O ) ) |
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。已知断裂1 mol N—N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则()
| A.N4的熔点比P4高 |
| B.1 mol N4气体转化为N2时要吸收724 kJ能量 |
| C.N4是N2的同系物 |
| D.1 mol N4气体转化为N2时要放出724 kJ能量 |
若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是Cu+2H+===Cu2++H2↑,则下列关于该装置的有关说法中正确的是()
| A.该装置可能是原电池,也可能是电解池 |
| B.该装置只能是原电池,且电解质溶液为硝酸 |
| C.该装置只能是电解池,且金属铜为该电解池的阳极 |
| D.该装置只能是原电池,电解质溶液不可能是盐酸 |
在N2(g)+3H2(g) 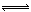 2NH3(g);△H<0。当分离出NH3后下列说法正确的是
2NH3(g);△H<0。当分离出NH3后下列说法正确的是
| A.平衡向逆向移动 | B.平衡不移动 |
| C.正反应速率先变大后变小 | D.逆反应速率先变小后变大 |