下列关于Na2O2的叙述正确的是 ( )
| A.Na2O2是淡黄色固体,久置于空气中变成Na2O |
| B.Na2O2与水的反应中,Na2O2只作氧化剂 |
| C.用Na2O2漂白过的织物、麦杆等日久又渐渐变成黄色 |
| D.Na2O2放入饱和NaOH溶液中,放出大量的O2,并有白色固体析出 |
地球是我们唯一的家园,保护地球环境是我们共同的使命与责任,下列措施不利于环境保护的是( )
| A.开发和利用太阳能、水能等能源 |
| B.合理利用石油、煤等不可再生资源 |
| C.工厂“三废”和生活污水处理后再排放 |
| D.为使农作物高产,大量施用化肥和农药 |
下列物质中可用于降低营养液的pH的是( )
| A.氢氧化物 | B.石膏 |
| C.磷酸 | D.盐酸 |
用溶液培养法培养某植株,发现幼嫩部分首先表现出病症,在溶液中加入某微量元素后症状消失,该元素是( )
| A.铁 | B.钾 |
| C.磷 | D.氮 |
科学家在利用无土栽培培养一些名贵花卉时,培养液中添加了多种必需元素,其配方如下,其中植物根吸收最少的离子是( )
| 离子 |
K+ |
Mg2+ |
Ca2+ |
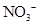 |
 |
 |
Zn2+ |
| 培养液浓度/ mmol·L-1 |
1 |
0.25 |
1 |
2 |
1 |
0.25 |
1 |
A.Zn2+ B.
C.Ca2+ D.
在NaCl、MgCl2和MgSO4三种盐配成的混合溶液中,若Na+为0.1 mol,Mg2+为0.25 mol,Cl-为0.2 mol,则 的物质的量为( )
的物质的量为( )
| A.0.5 mol | B.0.15 mol |
| C.0.2 mol | D.0.25 mol |