生物质能是一种洁净、可再生能源。生物质气(主要成分为等)与混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有等元素。写出基态原子的核外电子排布式。
(2)根据等电子原理,写出分子的结构式。
(3)甲醇催化氧化可得到甲醛,甲醛与新制的碱性溶液反应生成沉淀。
①甲醇的沸点比甲醛的高,其主要原因是;
甲醛分子中碳原子轨道的杂化类型为。
②甲醛分子的空间构型是;
1甲醛分子中键的数目为。
③在1个晶胞中(结构如图所示),

所包含的原子数目为。
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。回答下列问题: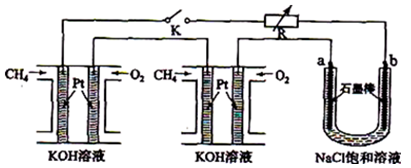
(1)甲烷燃料电池正极、负极的电极反应分别为、。
(2)闭合K开关后,a电极名称是 ,电极方程式为 。
(3)若标准状况下,每个燃料电池中通入1.12L甲烷气体完全反应,则电解池中产生氯气体积为L。
现有A、B、C、D、E、F六种有机物,它们的转化关系如下图所示(图中部分反应条件及生成物没有全部写出)。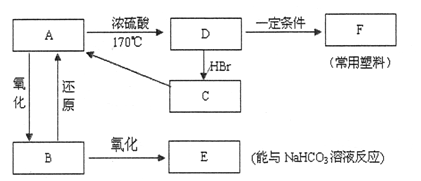
已知:液体B能发生银镜反应,气体D是一种植物生长调节剂,其相对分子质量为28。
请回答下列问题:
(1)B的结构简式,D、E官能团名称分别是、;
(2)D→A的化学方程式是;
(3)D→F反应的化学方程式是;
(4)在一定的条件下,A与E反应可生成一种具有香味的物质。该反应的化学方程式是。
(13分)短周期元素A、B、C、D、E的原子序数依次增大,其中B和E同主族。A元素的最高正化合价和最低负化合价的绝对值之差为2;1 mol C单质与冷水反应,在标准状况下生成11.2 L H2;D原子最外层电子数等于其周期序数;E-的电子层结构与Ar原子相同。
(1)用元素符号表示各元素A____、B_____、C_____、D______、E_____;
(2)能形成共价键的元素
(3)A的单质的电子式为______________
(4)C和B形成化合物的电子式______________
(5)写出C与水反应的离子方程式:
(共13分)由铜、锌和稀硫酸组成的原电池中:
(1)锌是极,电极反应式是。
铜是极,电极反应式是。
总反应式
(2)在铜极上可以观察到,在锌极可以观察到(填实验现象)
(3)下列装置能够组成原电池是()
(共13分)下表列出了a-f六种元素在周期表前三周期的位置。
| a |
|||||||
| b |
c |
||||||
| d |
e |
f |
请回答下列问题:
(1)c元素的名称是,d元素位于族。
(2)用元素符号表示六种元素中,性质最稳定的元素,元素的原子半径最大。
(3)非金属性bc(填“大于”“小于”)
(4)用化学式表示最高价氧化物属于两性氧化物的是,最高价氧化物对应水化物酸性最强的是
(5)写出e元素单质与NaOH反应的离子方程式
用电子式表示化合物df的形成过程。