单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500°),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。


 相关信息如下:
相关信息如下:
 a.四氯化硅遇水极易水解;
a.四氯化硅遇水极易水解;
 b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
 c.有关物质的物理常数见下表:
c.有关物质的物理常数见下表:

| 物质 | |||||
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
 请回答下列问题:
请回答下列问题:
 (1)写出装置中发生反应的离子方程式 。
(1)写出装置中发生反应的离子方程式 。
 (2)装置中管的作用是 ;装置中的试剂是;装置中的瓶需要冷却理由是 。
(2)装置中管的作用是 ;装置中的试剂是;装置中的瓶需要冷却理由是 。
 (3)装置中瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是(填写元素符号)。
(3)装置中瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是(填写元素符号)。
 (4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成,再用标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
(4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成,再用标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:

 ①滴定前是否要滴加指示剂?(填"是"或"否"),请说明理由。
①滴定前是否要滴加指示剂?(填"是"或"否"),请说明理由。
 ②某同学称取5.000残留物,预处理后在容量瓶中配制成100溶液,移取25.00,试样溶液,用1.000×10-2-1标准溶液滴定。达到滴定终点时,消耗标准溶液20.00,则残留物中铁元素的质量分数是 。
②某同学称取5.000残留物,预处理后在容量瓶中配制成100溶液,移取25.00,试样溶液,用1.000×10-2-1标准溶液滴定。达到滴定终点时,消耗标准溶液20.00,则残留物中铁元素的质量分数是 。
某同学设计了以下流程来检验碳酸钠粉末中含有少量氯化钠和氢氧化钠。
(1)步骤3的操作名称是;步骤1所需玻璃仪器是;
(2)试剂A是,加入试剂A 的目的是;(填字母编号)
a.检验OH- 离子 b. 检验Cl-离子
c.除去CO32-离子 d.避免对Cl-或OH-的检验的干扰
判断试剂A是否足量的方法是。
(3)步骤4是为了检验离子,所需要的试剂B是。
(4)请简述步骤5的具体操作过程(所加试剂、现象及结论)
孔雀石主 要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及纳米材料G,步骤如下:
要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及纳米材料G,步骤如下: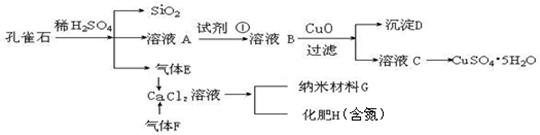
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①最佳为 (填代号),检验溶液A中Fe3+的最佳试剂为 (填代号)。
a.KMnO4/H+ b.Cl2 c.H2O2 d.KSCN
沉淀D中除了过量的CuO外,还存在另一种固体,其化学式为 ,
加入CuO作用是 。
(2)由溶液C获得CuSO4·5H2O,需要经过操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(3)制备纳米材料G时,应向CaCl2溶液中选通入(或先加入) (填化学式)。
写出该反应的化学方程式 。
(4)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应使用 。取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,终点现象为 。
为测定足量铜与适量一定浓度的浓硝酸反应生成的NO气体和NO2气体的物质的量之比(用m表示),请从下图中选用适当的实验装置,设计一个合理而简单的实验,用于测定m的值。其中E装置由甲、乙两根玻璃管组成,用橡皮管连通,并装入适量水,甲管有刻度(0mL~50mL),供量气用,乙管可上下移动,用来调节液面高低。




A B C D E
回答下列问题:
(1)实验中气体(NO和NO2)发生装置应选择(填装置序号)。
(2)要测定m值,需要将C中的溶液进行中和滴定,由于浓硝酸具有强 氧化性,能把酸碱指示剂氧化褪色而影响实验。因此,中和滴定前必须进行的操作是。
氧化性,能把酸碱指示剂氧化褪色而影响实验。因此,中和滴定前必须进行的操作是。
(3)装置的连接顺序是(填各装置接口的编号,连结胶管及夹持装置均省略)。
(4)连接好装置,检查气密性后,应进行两步必要的操作:
第一,打开b,向E装置右管中加适量水;
第二。
(5)实验前甲、乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面。此时应进行的操作是。
(6)实验后若量气管中气体的体积(换算成标准状况下)为V(L),C中硝酸的物质的量为 n mol,则用含n和V的式子表示m=。
(10分)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图: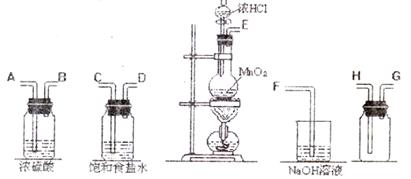
(1)连接上述仪器的正确顺序是(填各接口处的字母):E接,接,接H,G接F。
(2)在装置中;①饱和食盐水起的作用是;
②浓硫酸起的作用是。
(3)化学实验中检验是否有Cl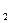 产生常用湿润的淀粉—KI试纸。如果有Cl
产生常用湿润的淀粉—KI试纸。如果有Cl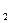 产生,可观察到的现象是,写出反应方程式。
产生,可观察到的现象是,写出反应方程式。
(4)写出下列化学反应的离子方程式
①气体发生装置中进行的反应:;
②尾气吸收装置中进行的反应:。
下图是实验室里的一种常用装置,利用它可进行若干实验。
(1)若在瓶中盛满水,用它作量气装置,则气体应从端通入,用它可以测量下列哪些气体的体积(填编号)。
①H2 ②O2 ③NH3 ④CO2
(2)若用它作干燥装置来干燥CO2气体,则气体应从端通入,瓶中可选用下列哪些干燥剂 (填编号)。
(填编号)。
①碱石灰 ②浓硫酸 ③生石灰
(3)若用它作气体的收集装置,用排空气法收集气体,当从A端通入气体时,可收集下列哪些气体(填编号)。
①CO2 ②H2 ③SO2④NH3