(化学-物质结构与性质)

 C和Si元素在化学中占有极其重要的地位。
C和Si元素在化学中占有极其重要的地位。 (1)写出Si的基态原子核外电子排布式 。
(1)写出Si的基态原子核外电子排布式 。 从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。 (2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。 (3)氧化物MO的电子总数与SiC的相等,则M为 (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 。
(3)氧化物MO的电子总数与SiC的相等,则M为 (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 。 (4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同。CO2中C与O原子间形成 键和
键和 键,SiO2中Si与O原子间不形成上述
键,SiO2中Si与O原子间不形成上述 健。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述
健。从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述 键 。
键 。
下列解释实验事实的方程式不准确的是( )。
A.0.1 mol·L-1 CH3COOH溶液的pH>1:CH3COOH CH3COO-+H+ CH3COO-+H+ |
B.“NO2球”浸泡在冷水中,颜色变浅: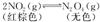 ΔH<0 ΔH<0 |
| C.铁溶于稀硝酸,溶液变黄:3Fe+8H++NO3-===3Fe2++2NO↑+4H2O |
D.向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO32-+H2O HCO3-+OH- HCO3-+OH- |
羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。现用25.00 mL 0.049 mol/L的羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+恰好与24.5 mL 0.02 mol/L的高锰酸钾酸性溶液完全反应,[已知:FeSO4+KMnO4+H2SO4―→Fe2(SO4)3+K2SO4+MnSO4+H2O(未配平)],则在上述反应中,羟胺的氧化产物是( )
| A.N2 | B.NO | C.NO2 | D.N2O |
如图两瓶体积相等的气体,在同温同压时两瓶内气体的描述一定正确的是()
| A.所含质子数相等 | B.气体密度相等 |
| C.气体质量相等 | D.平均摩尔质量相等 |
持40℃向其中加入少量CaO,在两种情况下均保持不变的是( )
| A.溶液中Ca2+的数目 |
| B.溶剂的质量 |
| C.溶液中溶质的物质的量浓度 |
| D.溶质的质量 |
取相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是()
| A.2:1:3 | B.6:3:2 | C.1:1:2 | D.3:2:1 |