运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
 (1)合成氨反应反应
(1)合成氨反应反应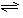 ,若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填"向左""向右"或"不");,使用催化剂反应的(填"增大""减小"或"不改变")。
,若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填"向左""向右"或"不");,使用催化剂反应的(填"增大""减小"或"不改变")。
 (2)
(2)
 则反应的=。
则反应的=。
 (3)在25℃下,向浓度均为0.1的和混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为。已知25℃时=1.8×10-11,=2.2×10-20。
(3)在25℃下,向浓度均为0.1的和混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为。已知25℃时=1.8×10-11,=2.2×10-20。
 (4)在25℃下,将的氨水与0.01的盐酸等体积混合,反应平衡时溶液则溶液显性(填"酸""碱"或"中");用含的代数式表示的电离常数=。
(4)在25℃下,将的氨水与0.01的盐酸等体积混合,反应平衡时溶液则溶液显性(填"酸""碱"或"中");用含的代数式表示的电离常数=。
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
已知:①4FeO·Cr2O3+ 8Na2CO3+ 7O2 8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
8Na2CrO4 + 2 Fe2O3 + 8CO2↑;
②Na2CO3 + Al2O3 2NaAlO2 + CO2↑;③Cr2O72-+ H2O
2NaAlO2 + CO2↑;③Cr2O72-+ H2O
 2CrO42- + 2H+
2CrO42- + 2H+
根据题意回答下列问题:
(1)固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是_________________________________。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、、过滤、_______、干燥。
(4)下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl →K2Cr2O7↓+2NaCl。
| 物质 |
溶解度/(g/100g水) |
||
| 0°C |
40°C |
80°C |
|
| KCl |
28 |
40.1 |
51.3 |
| NaCl |
35.7 |
36.4 |
38 |
| K2Cr2O7 |
4.7 |
26.3 |
73 |
| Na2Cr2O7 |
163 |
215 |
376 |
该反应在溶液中能发生的理由是_______________。
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量______(填写试剂)、溶解、过滤、再______(填写试剂)、灼烧、冷却、称量,得干燥固体m g 。计算样品中氢氧化铝的质量分数为_________(用含m、n的代数式表示)。
高锰酸钾(KMnO4)是一种常用的氧化剂。
(1)有下列变化:CO32-→CO2、C2O42-→CO2、Fe3+→Fe2+,找出其中一个变化与“MnO4-→Mn2+”组成一个反应,写出该反应配平后的离子方程式____________________。
(2)不同条件下高锰酸钾可发生不同如下反应:
MnO4-+5e+8H+→Mn2++4H2O MnO4-+3e+2H2O→MnO2+4OH-MnO4-+e→MnO42-
由此可知,高锰酸根离子(MnO4-)反应后的产物与有关。
(3)高锰酸钾可代替二氧化锰用来制取Cl2,反应中氧化剂和还原剂物质的量之比为_____________。
(4)高锰酸钾溶液与硫化亚铁在酸性条件下发生如下反应:
10FeS + 6KMnO4 + 24H2SO4 → 3K2SO4 + 6MnSO4 + 5Fe2(SO4)3 + 10S + 24H2O
若上述反应前后固体的质量减少了2.8g,则硫元素与KMnO4之间发生电子转移的数目为。
β型硼氮化合物—-(BN)n是一种无机合成材料[最简式为(BN)],具有高硬度、耐高温的特点,是做超高温耐热陶瓷材料、磨料、精磨刃具的好材料。用硼砂(Na2B4O7)与尿素在高温高压下反应可以获得。例如: Na2B4O7 + 2CO(NH2)2 → 4(BN) + Na2O + 2CO2
(1)请用氧化物的形式表示硼砂的化学式。β型(BN)n比晶体硅具有更高硬度和耐热性的原因是: 。
(21)上述反应式中具有4种不同能量电子的原子,它代表的元素在周期表中处于第周期,第族。
(3)能用于比较N与O非金属性相对强弱的事实是。
| A.最高价氧化物对应水化物的酸性 | B.H2O(g) 比NH3(g)稳定 |
| C.单质与H2反应的难易程度 | D.NO中氮元素显正价,氧元素显负价 |
(4)写出生成物中含极性键的非极性分子的电子式为。
(5)与硼同主族且相邻周期的元素,其最高价氧化物与NaOH溶液反应的离子方程式为:。
A—J是中学化学中常见的物质,它们之间的转化关系如下框图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。
请回答下列问题:
(1)A的化学式为,在水中的溶解性(选填“易溶”、“可溶”、“难溶”)。
(2)H溶液中通入过量的CO2,其反应的离子方程式是。
G→J的化学方程式为。
反应的现象是。
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因。
四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
| 元素 |
T |
X |
Y |
Z |
| 性质 结构 信息 |
人体内含量最多的元素,且其单质是常见的助燃剂。 |
单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼。 |
单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 |
第三周期元素的简单离子中半径最小 |
(1)写出元素T的离子结构示意图;写出元素X的气态氢化物的电子式;离子半径比较:Y离子Z离子(填“>”或“<”)。
(2)写出Z原子的核外电子排布式。
(3)Z的最高价氧化物对应水化物的电离方程式。
(4)元素T与氟元素相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目