 以黄铁矿为原料生产硫酸的工艺流程图如下:
以黄铁矿为原料生产硫酸的工艺流程图如下:


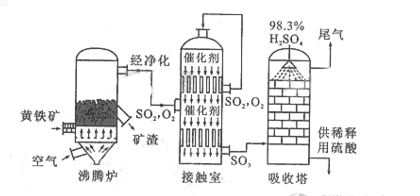

 (1)将燃烧黄铁矿的化学方程式补充完整
(1)将燃烧黄铁矿的化学方程式补充完整
 4 +11
4 +11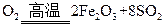
 (2)接触室中发生反应的化学方程式是 。
(2)接触室中发生反应的化学方程式是 。
 (3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
 a. 为使黄铁矿充分燃烧,需将其粉碎
a. 为使黄铁矿充分燃烧,需将其粉碎
 b. 过量空气能提高
b. 过量空气能提高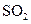 的转化率
的转化率
 c. 使用催化剂能提高
c. 使用催化剂能提高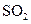 的反应速率和转化率
的反应速率和转化率
 d. 沸腾炉排出的矿渣可供炼铁
d. 沸腾炉排出的矿渣可供炼铁
 (4)每160g
(4)每160g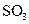 气体与
气体与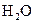 化合放出260.6kJ的热量,该反应的热化学方程是 。
化合放出260.6kJ的热量,该反应的热化学方程是 。
 (5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的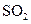 和铵盐。
和铵盐。
 ①
①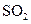 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的
既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的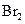 。
。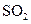 吸收
吸收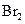 的离子方程式是 。
的离子方程式是 。
 ②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的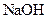 溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
 部分测定结果;
部分测定结果;
 铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
 计算:该铵盐中氮元素的质量分数是 %;若铵盐质量为15.00g。浓硫酸增加的质量为 。(计算结果保留两位小数)
计算:该铵盐中氮元素的质量分数是 %;若铵盐质量为15.00g。浓硫酸增加的质量为 。(计算结果保留两位小数)
下列溶液中的Cl-浓度与50mL 1mol/L MgCl2溶液中的Cl-浓度相等的是
| A.150 mL 1 mol/L NaCl溶液 | B.75 mL 2 mol/L CaCl2溶液 |
| C.150 mL 2 mol/L KCl溶液 | D.75 mL 1 mol/LAlCl3溶液 |
下列叙述正确的是
| A.元素的单质可由氧化或还原含该元素的化合物来制得 |
| B.得电子越多的氧化剂,其氧化性就越强 |
| C.阳离子只能得到电子被还原,只能做氧化剂 |
| D.含有最高价元素的化合物一定具有强的氧化性 |
要鉴别己烯中是否混有少量甲苯,正确的实验方法是
| A.先加足量的酸性高锰酸钾溶液,然后再加入溴水 |
| B.先加足量溴水,然后再加入酸性高锰酸钾溶液 |
| C.利用焰色反应,点燃这种液体,然后再观察火焰的颜色 |
| D.加入四氯化碳,萃取,观察是否分层 |
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是
| A.植物油是高分子化合物,不能使溴的四氯化碳溶液褪色 |
| B.淀粉水解的最终产物是葡萄糖 |
| C.葡萄糖能发生氧化反应和水解反应 |
| D.蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 |
下列关于有机物的说法错误的是:
| A.乙烯和苯都能使溴水褪色,褪色的原因不相同 |
| B.石油和天然气的主要成分都是碳氢化合物 |
| C.苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 |
| D.甲烷与氯气反应生成一氯甲烷和苯与硝酸反应生成硝基苯的反应类型相同 |