
 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和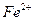 浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
 [实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
 (1)请完成以下实验设计表(表中不要留空格)。
(1)请完成以下实验设计表(表中不要留空格)。
实验 编号 编号 |
实验目的 |
T/K |
PH |
c/10-3mol·L-1 |
|
| H2O2 |
Fe2+ |
||||
| ① |
为以下实验作参考 |
298 |
3 |
6.0 |
0.30 |
| ② |
探究温度对降解反应速率的影响 |
|
|
|
|
| ③ |
 |
298 |
10 |
6.0 |
0.30 |
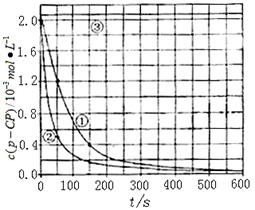
 [数据处理]实验测得p-CP的浓度随时间变化的关系如右上图。
[数据处理]实验测得p-CP的浓度随时间变化的关系如右上图。
 (2)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率:
(2)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率:

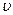 (p-CP)= mol·L-1·s-1
(p-CP)= mol·L-1·s-1
 [解释与结论]
[解释与结论]
 (3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因: 。
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因: 。
 (4)实验③得出的结论是:PH等于10时, 。
(4)实验③得出的结论是:PH等于10时, 。
 [思考与交流]
[思考与交流]
 (5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法: 
分别将等物质的量浓度的KCl、MgCl2、AlCl3三种溶液中的Cl‒完全沉淀,消耗相同物质的量浓度的AgNO3溶液的体积比为3 : 2 : 1,则上述三种溶液的体积比为
| A.1:1:1 | B.6:3:2 | C.3:2:1 | D.9:3:1 |
实验室制取氯气后,产生的尾气选用下列哪种方法处理最好:
检验氯化氢气体中是否混有Cl2,可采用的方法是
| A.用干燥的蓝色石蕊试纸 | B.用干燥有色布条 |
| C.将气体通入硝酸银溶液 | D.用湿润的淀粉-碘化钾试纸 |
如右图所示装配好仪器,接通直流电源,电解的是未精制的(含有少量CaCl2、MgCl2、Na2SO4等杂质)饱和食盐水,结果很快在某一电极附近出现浑浊现象。造成浑浊的难溶物主要是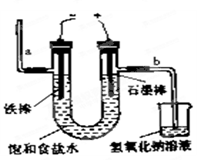
| A.碳酸镁 | B.硫酸钡 | C.氢氧化镁 | D.碳酸钡 |
如右图所示装配好仪器,接通直流电源,电解饱和食盐水,则电解一段时间后,在碳棒和铁钉表面都有气体生成,其中碳棒表面生成的气体是
| A.Cl2 | B.O2 | C.H2 | D.HCl |