在密闭的容器中进行如下的反应:,在温度和时,产物的量彧时间的关系如下图所示,符合图象的正确的判断是()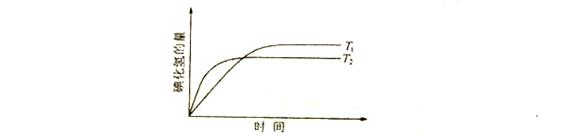
| A. | > , >0 | B. | > , <0 |
| C. | < , >0 | D. | < , <0 |
下列A、B两种元素的原子序数,其中可以组成AB2型共价化合物的是
A.19和16 B.6和8 C.12和8 D.10和2
下列说法中,正确的是
| A.非金属元素之间形成的化合物一定是共价化合物 |
| B.在气态单质分子中不一定存在着共价键 |
| C.两个原子或多个原子之间的相互作用叫化学键 |
| D.离子化合物中一定含有离子键,不存在共价键 |
下列关于硅的说法中,不正确的是
| A.硅是非金属元素,晶体硅是灰黑色有金属光泽的固体 |
| B.硅的导电性能介于金属和绝缘体之间,是良好的半导体材料 |
| C.硅的化学性质不活泼,常温下不与任何物质反应 |
| D.二氧化硅常被用来制造光导纤维 |
元素X形成的离子与钙离子的核外电子排布相同,且X的离子半径小于S2—的半径,X元素为
| A.Al | B.P | C.K | D.Ar |
今有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍,A和B分别是
A.硅原子和钠原子 B.硼原子和氢原子
C.碳原子和铝原子 D.氮原子和碳原子