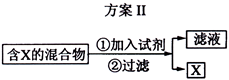
下图表示从固体混合物中分离的2种方案,请回答有关问题。

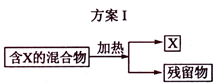
 (1)选用方案I时,应该具有的性质是 ,残留物应该具有的性质是;
(1)选用方案I时,应该具有的性质是 ,残留物应该具有的性质是;
 (2)选用方案Ⅱ从某金属粉末(含有、和)中分离,加入的试剂是,有关反应的化学方程式为;
(2)选用方案Ⅱ从某金属粉末(含有、和)中分离,加入的试剂是,有关反应的化学方程式为;
 (3)为提纯某样品(主要杂质有、),参照方案I和Ⅱ,请设计一种以框图形式表示的实验方案(注明物质和操作)。
(3)为提纯某样品(主要杂质有、),参照方案I和Ⅱ,请设计一种以框图形式表示的实验方案(注明物质和操作)。
按要求填空,(每空2分,共6分)
双氧水(H2O2)和水都是极弱电解质,但H2O2比H2O更显酸性。
(1)若把H2O2看成是二元弱酸,请写出它在水中的电离方程式:_______________
(2)写出实验室用双氧水制取氧气的化学方程式:
(3)鉴于H2O2显弱酸性,它可以同强碱作用形成正盐,在一定条件下也可形成酸式盐。请写出H2O2与Ba(OH)2作用形成正盐的化学方程式:______________
2.3g钠溶于水中形成溶液,所得溶液中Na+和H2O的个数比为1:100,则最初需要加入克水。
有甲、乙、丙三种元素,甲元素M层的电子数是其K层的电子数的1/2,乙元素原子核内无中子,丙元素原子核内有8个质子。
(1)写出乙、丙两种元素形成的两种化合物的化学式 ,
(2)写出甲、乙、丙三种元素组成的化合物在水中的电离方程式
(3)画出甲元素的原子结构示意图和丙离子的结构示意图 ,
同温同压下的氮气和氢气,若体积相同时,两种气体的质量比为___________,其密度比为___________;若质量相等时,两种气体的体积比___________。
实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓)=2KCl+MnCl2+5Cl2↑ +8H2O
(1)该反应中的还原剂是,氧化产物是
(2)氧化剂与还原剂之比是
(3)如反应中转移了0.6mol电子,则产生的气体在标准状况下体积为