光卤石是化工生产中一种重要的中间产物,其化学成分是KCl·MgCl2·6H2O。当用光卤石为原料制取金属镁时,一共有下列几步:①过滤②溶解 ③加入适量Ca(OH)2④蒸发⑤用盐酸溶解⑥电解熔融MgCl2⑦在HCl气流中强热MgCl2·6H2O晶体,正确的顺序是( )
| A.⑤③①②④⑥⑦ | B.②③①⑤④⑦⑥ |
| C.②④①③⑦⑤⑥ | D.⑤③①④②⑦⑥ |
下列实验能达到目的的是
| A.配制150 mL 0.10 mol/L盐酸 | B.除去乙醇中的乙酸 |
| C.制备Fe(OH)2 | D.除去CO中的CO2 |
下列实验设计能够成功的是
A.检验亚硫酸钠试样是否变质:试样 沉淀不溶解 沉淀不溶解 |
B.除去乙酸乙酯中混有的乙酸:混合液 得上层液体 得上层液体 |
C.证明酸性条件下H2O2氧化性比I2强: NaI溶液 溶液变蓝色 溶液变蓝色 |
| D.鉴定盐A的成分是FeBr2: |

某氯碱厂利用废铁皮制取净水剂FeCl3溶液,最合理的生产途径是
下列实验操作正确的是
| A.可用氨水除去试管内壁上的银镜 |
| B.硅酸钠溶液应保存在带玻璃塞的试剂瓶中 |
| C.将三氯化铁溶液蒸干,可制得无水三氯化铁 |
| D.锌与稀硫酸反应时,要加大反应速率可滴加少量硫酸铜 |
一定温度下,向体积为2L的密闭容器中充入1mol PCl5(g),发生反应:
PCl5(g)  PCl3(g) +Cl2(g)△H=+Qkj.mol-1维持容器温度不变,测得容器内压强随反应时间的变化如图5所示。下列说法正确的是
PCl3(g) +Cl2(g)△H=+Qkj.mol-1维持容器温度不变,测得容器内压强随反应时间的变化如图5所示。下列说法正确的是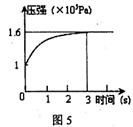
| A.3s内的平均速率为:v(PCl3)="0.1" mol·L-1.s-1 |
| B.达到平衡时放出0.6Q kJ热量 |
| C.其他条件不变,升高温度,平衡常数减小 |
| D.其他条件不变,再向容器中充入1mol PCl5(g),则达新平衡时,c(PCl5)>0.4mol·L-1 |