人们常将在同一原子轨道上运动的,自旋方向相反的2个电子,称为“电子对”;将在同
一原子轨道上运动的单个电子,称为“未成对电子”。以下有关主族元素原子的“未成对电子”
的说法,错误的是( )






| A.核外电子数为奇数的基态原子,其原子轨道中一定含有“未成对电子” |
| B.核外电子数为偶数的基态原子,其原子轨道中一定不含“未成对电子” |
| C.核外电子数为偶数的基态原子,其原子轨道中可能含有“未成对电子” |
| D.核外电子数为奇数的基态原子,其原子轨道中可能不含“未成对电子” |
向0.1 mol/L的氨水溶液中加水稀释或加入少量NH4Cl固体时均会引起变化的是
| A.溶液的导电能力减弱 | B.溶液的pH变小 |
| C.NH3·H2O的电离度变大 | D.Kw(水的离子积常数)变大 |
密闭容器中进行下列反应:M(g)+N(g) R(g)+2 L,如图所示R%是R的体积分数,t是时间,下列关于该反应的分析正确的是
R(g)+2 L,如图所示R%是R的体积分数,t是时间,下列关于该反应的分析正确的是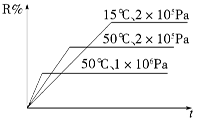
| A.正反应吸热,L为气体 |
| B.正反应吸热,L为固体或纯液体 |
| C.正反应放热,L为气体 |
| D.正反应放热,L为固体或纯液体 |
下列有关电解质溶液的说法正确的是
| A.在蒸馏水中滴加浓H2SO4,KW不变 |
| B.CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) |
| D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.通入少量HCl气体,溶液中PH值增大 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
下列各电离方程式中,书写正确的是
| A.CH3COOH === H++CH3COO- | B.KHSO4  K++H++SO42- K++H++SO42- |
C.Al(OH)3 Al3++3OH- Al3++3OH- |
D.NaH2PO4  Na++H2PO4- Na++H2PO4- |