2001年9月1日执行的国家食品卫生标准规定,酱油中3-氯丙醇(ClCH2CH2CH2OH)含量不得超过1ppm。相对分子质量为94.5的氯丙醇(不含 的结构)共有 
| A.2种 | B.3种 | C.4种 | D.5种 |
一定温度下,反应N2(g)+3H2(g)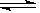 2NH3(g)不能作为达到平衡状态的依据的是( )。
2NH3(g)不能作为达到平衡状态的依据的是( )。
| A.N2,H2和NH3的质量分数不再改变 |
| B.c(N2)∶c(H2)∶c(NH3)=1∶3∶2 |
| C.断开1 mol H-H的同时形成1 mol H-H |
| D.单位时间里每增加1 mol N2,同时消耗3 molH2 |
可逆反应2A(g)+3B(g)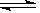 2C(g)+D(g)在四种不同条件下的反应速率分别为:
2C(g)+D(g)在四种不同条件下的反应速率分别为:
①v(A)="0.5" mol/(L·min)②v(B)="0.6" mol/(L·min)
③v(C)="0.35" mol/(L·min)④v(D)="0.4" mol/(L·min)
则该反应在不同条件下反应速率最快的是()
A.① B.② C.③ D.④
某一反应物的浓度是2.0 mol/L,经过4 min后,它的浓度变成了1.68 mol/L,则在这4 min内它的平均反应速率为()。
| A.0.2 mol·L-1·min-1 | B.0.1 mol·L-1·min-1 | C.0.04 mol·L-1·min-1 | D.0.08 mol·L-1·min-1 |
10 mL 1mol/L的盐酸与一小块大理石的化学反应CaCO3+2HCl=CaCl2+CO2↑+H2O,下列措施能使化学反应速率提高的是()。
| A.加入一定量的CaCl2 | B.加入5 mL 1.5 mol/L的盐酸 |
| C.加入15 mL 0.5 mol/L的盐酸 | D.加入5 mL H2O |
下列说法不正确的是()。
| A.温度升高,正逆反应速率都增大。 |
| B.化学反应的速率和限度均可通过改变化学反应条件而改变。 |
| C.水的生成与电解是可逆反应。 |
| D.化学反应达到平衡状态时,正反应速率与逆反应速率相等。 |