近年来,乳酸CH3CH(OH)COOH成为人们的研究热点之一。乳酸可以用化学方法合成,也可以由淀粉通过生物发酵法制备。乳酸有许多用途,其中利用乳酸的聚合而合成的高分子材料,具有很好的生物兼容性,它无论在哺乳动物体内或自然环境中,最终都能够降解成为二氧化碳和水。请回答下列有关问题:
(1)乳酸在发生下列变化时所用的试剂是① ②
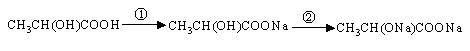
(2)乳酸可以跟精制的铁粉反应制备一种补铁的药物,反应的化学方程式为:
2CH3CH (OH) COOH+Fe→[CH3CH(OH)COO]2Fe+H2↑
该反应中氧化剂是 ,还原产物是
(3)由乳酸可以制取 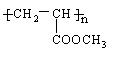 ,请写出设计合成实验时所涉及的有机反应类型 。
,请写出设计合成实验时所涉及的有机反应类型 。
(4)聚乙烯、聚苯乙烯材料因难分解而给人类生存环境带来严重的“白色污染”,德国Danone公司开发了聚乳酸材料  ,它是由乳酸通过 反应制取的。聚乳酸包装材料能够在60天自行降解,降解过程分为两个阶段,首先在乳酸菌的作用下水解生成单体,然后乳酸单体在细菌的作用下与氧气反应转化为二氧化碳和水,请写出上述两个反应的化学方程式 ,
,它是由乳酸通过 反应制取的。聚乳酸包装材料能够在60天自行降解,降解过程分为两个阶段,首先在乳酸菌的作用下水解生成单体,然后乳酸单体在细菌的作用下与氧气反应转化为二氧化碳和水,请写出上述两个反应的化学方程式 ,
(5)若碳原子以单键与四个不同的原子或原子团相结合,则称该碳原子为“手性碳原子”,含有手性碳原子的分子称为“手性分子”,手性分子往往具有一定生物活性。乳酸分子是手性分子,乳酸[③CH3②CH(OH)①COOH]的手性碳原子是 号碳原子。
(6)乳酸的某种同分异构体具有下列性质:能发生银镜反应;1 mol该物质跟足量金属钠发生缓慢反应,生成2g氢气;该分子为手性分子。写出该物质的结构简式
下表是元素周期表的一部分, 针对表中的①~⑧种元素,填写下列空白:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA[ |
零 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④[ |
⑤ |
⑥ |
⑦ |
⑧ |
(1)上述元素中,化学性质最不活泼的是 (填元素符号)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 (填元素符号)。
(3)元素②的气态氢化物分子属于 (填电解质或非电解质);元素⑦与④形成化合物的电子式是 。
(4)元素⑤的最高价氧化物与氢氧化钠溶液反应的离子方程式为: 。
(5)元素④的某氧化物可作供氧剂,该氧化物中所含的化学键类型有 ,写出其与二氧化碳反应的化学方程式 。
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
请回答下列问题:
(1)硫铁矿“焙烧”中反应的化学方程式为3FeS2 +8O2 + 6SO2,则中的化学式为 ,反应中化合价升高的元素有 。
+ 6SO2,则中的化学式为 ,反应中化合价升高的元素有 。
(2)“酸溶”中反应的化学方程式为 。
(3)“过滤”后滤液中金属阳离子有 。
(4)“氧化”中反应的离子方程式为 。
(5)该工艺流程中产生的SO2会污染空气,常用烧碱溶液来吸收。写出吸收过程中反应的化学方程式 。
化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)锌锰干电池是应用最普遍的电池之一(如图所示),锌锰干电池的负极材料是 ,负极发生的电极反应方程式为: 。若反应消耗16.25 g 负极材料,则电池中转移电子的物质的量为 mol。
(2)目前常用的镍(Ni)镉(Cd)电池其电池总反应式可以表示为:Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是____。
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法中正确的是____。
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
| A.①③ | B.②④ | C.①④ | D.②③ |
(3)下图为氢氧燃料电池的构造示意图,根据电子运动方向可知,则X极为电池的______(填“正”或“负”)极,Y极的电极反应方程式为 。
乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的结构简式为 ,A的官能团为 (填名称)。
(2)下列物质中,不能通过乙烯加成反应得到的是 (填序号)。
| A.CH3CH3 | B.CH3CHCl2 | C.CH3CH2OH | D.CH3CH2Br |
(3)已知2CH3CHO+O2 2CH3COOH若以乙烯为主要原料合成乙酸,其合成路线如下图所示:
2CH3COOH若以乙烯为主要原料合成乙酸,其合成路线如下图所示: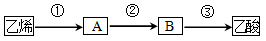
a.反应②的化学方程式为 。
b.工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为 ,反应类型是 。
已知四种元素A、B、C、D,其原子序数依次增大,最外层电子数依次为4、1、2、7,其中A元素原子次外层电子数为2,B、C 两元素的原子次外层电子数为8,B元素原子最外层电子数比第1层电子数少1,也比C元素原子第M层电子数少1,D元素的单质为液态非金属单质。若此四种元素均位于元素周期表前四个周期,请按要求填写下列各题:
(1)A原子的原子结构示意图为 ,D元素在元素周期表中的位置为 。
(2)B元素的最高价氧化物对应的水化物用电子式表示为 ,C、D两元素形成的化合物化学键类型为 。
(3)请写出D元素的单质与SO2同时通入水中反应的化学方程式: 。