化合物A是石油化工的一种重要原料,用A和水煤气为原料经图所示途径合成化合物D(分子式为C3H6O3)。
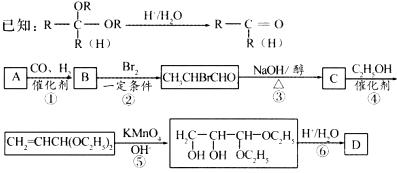
请回答下列问题:
(1)写出下列物质的结构简式:A ;B ;C ;D 。
(2)指出反应②的反应类型: 。
(3)写出反应③的化学方程式: 。
(4)反应④的目的是 。
(5)化合物D′是D的一种同分异构体,它最早发现于酸牛奶中,是人体内糖类代谢的中间产物。D′在浓硫酸存在的条件下加热,既可以生成能使溴水褪色的化合物E(C3H4O2),又可以生成六原子环状化合物F(C6H8O4)。请分别写出D′生成E和F的化学方程式:
D′→E: 。
D′→F: 。
下列说法正确的是
| A.废旧电池应集中回收,并填埋处理 |
| B.充电电池放电时,电能转变为化学能 |
| C.放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关 |
| D.所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 |
已知热化学方程式:SO2(g)+ O2(g) 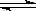 SO3(g)△H =" ―98.32" kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
SO3(g)△H =" ―98.32" kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
| A.196.64kJ | B.196.64kJ/mol |
| C.<196.64kJ | D.>196.64kJ |
汽车尾气无害化处理反应为2NO(g)+2CO(g) N2(g)+2CO2(g)。下列说法不正确的是
N2(g)+2CO2(g)。下列说法不正确的是
| A.反应达到平衡后,NO的反应速率保持恒定 |
| B.使用高效催化剂可有效提高该反应的正、逆反应速率 |
| C.升高温度可使该反应的逆反应速率降低 |
| D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
反应A(g)+3B(g)  2C(g)在2L密闭容器中反应,半分钟内C的物质的量增加了0.6mol,有关反应速率中正确的是
2C(g)在2L密闭容器中反应,半分钟内C的物质的量增加了0.6mol,有关反应速率中正确的是
A.v(A)="0.005" mol·L-1·s-1 B.v(C)="0.02" mol·L-1·s-1
C.v(B)= v(A)/3D..v(A)="0.01" mol·L-1·s-1
对于在一定条件下进行的化学反应:2SO2+O2 2SO3,改变下列条件,可以提高反应物中的活化分子百分数的是
2SO3,改变下列条件,可以提高反应物中的活化分子百分数的是
| A.升高温度 | B.增大压强 | C.压缩使容器体积变小 | D.增大反应物浓度 |