亚硝酸盐广泛存在于自然环境中,如蔬菜、肉类、豆类等都可以测出一定量的亚硝酸盐,一般情况下,当人体一次性摄取得300~500 mg亚硝酸钠时,就会引起中毒。某研究性学习小组用碘量法测定泡菜中亚硝酸盐的含量,反应方程式如下: 2NaNO2+2H2SO4+2KI==2NO+I2+K2SO4+Na2SO4+2H2O,2Na2S2O3+I2==Na2S4O6+2NaI。取l kg泡菜榨汁,将榨出的液体收集后,加入提取剂和氢氧化钠,使得到的泡菜汁中的亚硝酸盐都成为亚硝酸钠,在过滤后的滤液中加入氢氧化铝乳液,以除去色素,再次过滤后得到滤液,将该滤液稀释至1L,取25.00 mL菜汁与过量的稀硫酸和碘化钾溶液的混合液反应,再选用合适的指示剂,用较稀的硫代硫酸钠溶液进行滴定,共消耗0.050 mol·L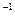 Na2S2O3溶液20.00 mL。请回答下列问题:
Na2S2O3溶液20.00 mL。请回答下列问题:
(1)该实验中可选用的指示剂是 。
(2)通过计算判断若某人一次食入0.125 kg这种泡菜,是否会引起中毒?
(3)有经验的厨师在做泡菜时往往加入适量的橙汁,以减轻亚硝酸盐的危害,主要是因为橙汁中含有丰富的维生素C,说明维生素C具有 性。
NA为阿伏伽德罗常数值下列说法正确的是()
| A.30g丙醇中存在的共价键总数为5NA |
| B.密闭容器中2mol NO与1mol O2充分反应,转移的电子数为2NA |
| C.常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子总数为2NA |
| D.2.8g乙烯和环丁烷(C4H8)的混合气体中含有的原子总数为0.6NA |
下列有关“化学与生活”的叙述不正确的是()
| A.烧结粘土制陶瓷涉及化学变化 |
| B.加工后具有吸水性的植物纤维可用作食品干燥剂 |
| C.点燃爆竹后,硫燃烧生成SO3 |
| D.服用阿司匹林出现水杨酸反应时,用碳酸氢钠溶液解毒 |
己烷雌酚的一种合成路线如下: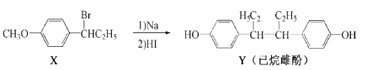
下列叙述不正确的是()
| A.用FeCl3溶液可以鉴别化合物X和Y |
| B.Y的苯环上的二氯取代物有7种同分异构体 |
| C.在NaOH水溶液中加热,化合物X发生消去反应 |
| D.X转化为Y的反应类型为取代反应 |
某稀硫酸和稀硝酸的混合溶液200ml,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解m g。向另一份中逐渐加入铁粉,产生的气体量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)下列分析或结果错误的是()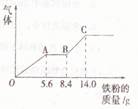
| A.第二份溶液中最终溶质为FeSO4 |
| B.原混合酸中NO3-物质的量为0.1mol |
| C.m值为9.6 |
| D.H2SO4浓度为2.5mol/L |
在15.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成25.4g沉淀,则下列表示气体X组成的选项中合理的是()
| A.0.3mol NO、0.1mol NO2 | B.0.3mol NO2 |
| C.0.6mol NO | D.0.3mol NO2、0.1mol NO |