下列可用氢键来解释的是
A.浓的氢氟酸溶液中存在HF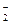 和H2F 和H2F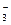 |
| B.SiH4沸点比CH4高 |
| C.水和乙醇分别与金属钠反应,前者比后者剧烈 |
| D.H2O比H2S稳定,前者1000℃以上才分解,后者300℃分解 |
下列有关物质的性质或应用均正确的是
| A.工业上分别用电解氧化镁和氧化铝的方法制备镁和铝 |
| B.为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
| C.氢氧化镁分解时吸收大量的热量,添加到合成树脂中可作阻燃剂 |
| D.Na2CO3受热能分解产生CO2气体,在食品工业中可作为焙制糕点的膨松剂 |
常温下在下列给定条件的溶液中,一定能大量共存的离子组是
A.能使pH试纸呈红色的溶液:Na+、NH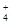 、I-、NO 、I-、NO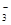 |
B.加入铝粉生成H2的溶液:K+、Mg2+、SO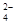 、HCO 、HCO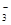 |
| C.l.0 mol·L-1 NaClO溶液:Fe2+、K+、I一、Cl- |
| D.在c(H+)/c(OH-) = 1×1013的溶液:NH4+、Ca2+、C1-、K+ |
下列化学用语表示正确的是
A.Na2S的电子式: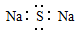 |
B.质子数为53,中子数为78的碘原子: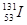 |
C.S2-的结构示意图: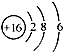 |
D.HOCH2COOH缩聚物的结构简式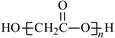 |
资源的回收和合理利用可促进社会的可持续发展。下列说法正确的是
| A.“地沟油”禁止食用,但可以用来制肥皂 |
| B.将废弃的电池、金属、纸制品等垃圾分类回收 |
| C.利用农作物秸秆制取乙醇 |
| D.直接焚烧废旧塑料,防止白色污染 |
【北京理综】酸雨的形成如右图所示,下列说法正确的是()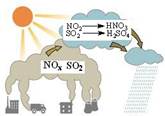
| A.酸雨是指pH<7的雨水 |
| B.汽车尾气中含有NOx是因汽油中含有N |
| C.利用煤的液化、气化等物理变化实现综合利用 |
| D.硫酸型、硝酸型酸雨形成均涉及氧化还原反应 |