下表是三个不同短周期部分元素的原子半径及其主要化合价:
| 元素代号 |
W |
R |
X |
Y |
Z |
| 原子半径/nm |
0.037 |
0.157 |
0.066 |
0.070 |
0.077 |
| 主要化合价 |
+1 |
+1 |
-2 |
-3、+5 |
+2、+4 |
试回答下列问题:
(1)五种元素中原子半径最大的元素在周期表中位于 。
(2)写出下列有关反应的化学方程式:
①Z的单质与Y元素的最高价氧化物对应的水化物反应:
;
②R2X2与ZX2反应: 。
(3)X可与Z形成一种有恶臭味的气体,该气体与氧气发生反应的物质的量之比为1:2,且反应前后气体的总体积不变,试写出该气体分子(分子中各原子最外层均满足8e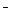 结构,且含有非极性键)的电子式: 。
结构,且含有非极性键)的电子式: 。
某氯化钠样品中含有少量的硫酸钠和碳酸钠杂质,按下列流程进行净化,回答下列问题。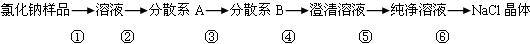
(1)分散系A、B都属于(选填“溶液”“胶体”或“浊液”)。
(2)写出以下步骤所需的试剂(用化学式表示)
②③⑤
(3)写出以下步骤的实验操作名称①④⑥
(4)第④步中要用到的玻璃仪器有烧杯、、
(5)写出第②步有关反应的离子方程式
(1)在一定条件下可以进行如下反应:H2O +R2O8n-+Mn2+→MnO4-+RO42-+ H+ (未配平),又知该反应中氧化剂与还原剂的物质的量之比为5:2,则R2O8n-中n的值为。
(2)反应 2KMnO4 + 16HCl =" 2KCl" + 2MnCl2 + 5Cl2↑ + 8H2O 可用于实验室制取氯气
①用双线桥表示出该反应的电子转移情况:
2KMnO4 + 16HCl =" 2KCl" + 2MnCl2+ 5Cl2↑+ 8H2O
②在标准状况下,该反应产生2.24 L Cl2时,消耗氧化剂mol,被氧化的物质的质量为g。
有A、B、C三种常见的金属单质,A在空气中燃烧生成淡黄色固体;B也能在空气中剧烈燃烧,发出耀眼的白光;C在一定条件下与水蒸气反应生成H2和一种黑色固体。根据以上信息回答下列问题:
(1)写出化学式ABC
(2)写化学方程式①A在空气中燃烧
②C与水蒸气反应
③A与水反应
用一种试剂除去下列物质中的杂质(括号内物质为杂质,所用试剂均为适量),写出所加的试剂及有关反应的离子方程式。
(1) FeSO 4溶液(CuSO 4):试剂
离子方程式
(2) Mg(Al):试剂
离子方程式
(3) CO(CO 2):试剂
离子方程式
A、B、C、D均为中学化学中常见的物质,它们之间的转化关系如下图(部分产物已略去):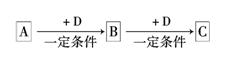
试回答:
(1)若D是金属,C溶液在储存时应加入少量D;D在潮湿的空气中易被腐蚀,写出常见腐蚀形式的正极反应式:。
(2)若A、B、C为含同一种金属元素的无机物,在溶液中A和C反应生成B,请写出在溶液中A和C反应生成B 可能的离子方程式(写出两个即可):
、。