阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是( )
(1)0.25molNa2O2中含有的阴离子数为0.5×6.02×1023
(2)7.5gSiO2晶体中含有的硅氧键数为0.5×6.02×1023
(3)2.24LCH4中含有的原子数为0.5×6.02×1023
(4)250mL2mol/L的氨水中含有NH3·H2O的分子数为0.5×6.02×1023
(5)1L 1mol·L―1的HAc溶液中含有6.02×1023个氢离子
(6)18g D2O(重水)完全电解,转移6.02×1023个电子
(7)22.4L SO2气体,所含氧原子数为2×6.02×1023
(8)14g乙烯和丙烯的混合物中,含有共用电子对数目为3×6.02×1023
| A.2个 | B.3个 | C.5个 | D.6个 |
下列液体均处于25℃,有关叙述正确的是
| A.某物质的溶液pH<7,向该溶液中加入氢氧化钠溶液,Kw增大 |
| B.pH=8的NaOH溶液稀释100倍,其pH=6 |
| C.将1L 0.1mol·L-1的Ba(OH)2溶液稀释为2L,pH=12 |
| D.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
从下列事实所列出的相应结论正确的是
| 实验事实 |
结论 |
|
| A |
Cl2的水溶液可以导电 |
Cl2是电解质 |
| B |
SO2通入硝酸钡溶液出现白色沉淀 |
BaSO3不溶于强酸 |
| C |
NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 |
结合H+的能力:CO32-<AlO2- |
| D |
常温下白磷可自燃而氮气须在放电时才与氧气反应 |
非金属性:P>N |
一定温度下,用水稀释c mol·L-1的稀醋酸,若用KW表示水的离子积,则下列数值随水量的增加而增大的是
A.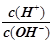 |
B.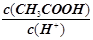 |
C.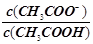 |
D. |
常温下向10 mL 0.1mol·L–1氨水中缓缓加蒸馏水稀释到1 L后,下列变化中正确的是
①电离程度增大;②c(H+)增大;③导电性增强;④ 不变;⑤OH–数目增大,H+数目减小;⑥pH增大;⑦ c(H+)与c(OH–)的乘积减小
不变;⑤OH–数目增大,H+数目减小;⑥pH增大;⑦ c(H+)与c(OH–)的乘积减小
| A.①②④ | B.①⑤⑥ | C.除②外都正确 | D.①④⑤⑥⑦ |
常温下,有关①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液,四种溶液的比较中,正确的是
| A.水电离的c(H+):①=②=③=④ |
| B.将②、③溶液混合后pH=7,则消耗溶液的体积:②=③ |
| C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
| D.向溶液中加入100mL水后,溶液的pH:③>④>①>② |