 A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D、C与F分别在同一主族,A、D两元素的原子核内的质子数之和是C、F两元素原子核内质子数之和的一半。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D、C与F分别在同一主族,A、D两元素的原子核内的质子数之和是C、F两元素原子核内质子数之和的一半。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题: (1)B元素的原子结构示意图为: ;
(1)B元素的原子结构示意图为: ; (2)由A、B、C三元素可以组成盐X,X中存在的化学键类型是: ;
(2)由A、B、C三元素可以组成盐X,X中存在的化学键类型是: ; (3)E是非金属元素,但能表现出一些金属元素的性质,请写出E与D元素的最高价氧化物的水化物反应的离子方程式: ;
(3)E是非金属元素,但能表现出一些金属元素的性质,请写出E与D元素的最高价氧化物的水化物反应的离子方程式: ; E、B两元素在一定条件下可合成用于制造轴承、永久模具的新型无机非金属材料,该材料的化学式为 ,其晶体类型是 晶体;
E、B两元素在一定条件下可合成用于制造轴承、永久模具的新型无机非金属材料,该材料的化学式为 ,其晶体类型是 晶体; (4)一定条件下,A的单质气体与B的单质气体充分反应生成6.8gW气体[已知n(A)∶n(B)=3∶1],可放出18.44kJ热量,则该反应的热化学方程式: 。
(4)一定条件下,A的单质气体与B的单质气体充分反应生成6.8gW气体[已知n(A)∶n(B)=3∶1],可放出18.44kJ热量,则该反应的热化学方程式: 。 (5)F、C分别与A形成的化合物的熔、沸点A2F A2C(填“>”“<”或“=”)。
(5)F、C分别与A形成的化合物的熔、沸点A2F A2C(填“>”“<”或“=”)。
(1) 碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
KIO3+KI+H2SO4=K2SO4+I2+H2O
(2) 上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液(Na2SO3在有水参与时被氧化为Na2SO4),将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体;
以上设计中遗漏的操作及在上述步骤中的位置是。
工业上用亚硫酸氢钠(NaHSO3)与碘酸钠(NaIO3)反应制备单质碘。试配平该反应的化学方程式,并标出电子转移的总数及方向。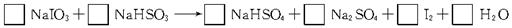
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-→NO↑+2H2OKMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质能使上述还原过程发生(该反应中-2价的O不能被氧化)。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了、性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是mol。
请写出下列反应的离子方程式
①少量二氧化碳通入澄清石灰水中②氯化钠溶液与硝酸银溶液混合
③碳酸钙与稀硝酸反应④氢氧化铁加入稀盐酸
.下列物质中:①固体NaCl②铜③二氧化碳④熔融KOH⑤稀硫酸⑥酒精⑦碳酸钙晶体能导电的;属于电解质的是;属于非电解质的是。