利用碱性氧化性溶液的氧化作用,在钢铁表面形成一层深蓝色的Fe3O4(也可表示为FeFe2O4)薄膜,保护内部金属免受腐蚀,这种方法叫做烤蓝。烤蓝时发生如下反应: ① 3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
① 3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑ ② Na2FeO2+NaNO2+H2O—Na2Fe2O4+NH3↑+NaOH(未配平)
② Na2FeO2+NaNO2+H2O—Na2Fe2O4+NH3↑+NaOH(未配平) ③ Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
③ Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH 下列说法中正确的是
下列说法中正确的是
A.Fe3O4既可看作是氧化物,又可看作是亚铁盐  |
B.反应②配平后,H2O的化学计量数为3 |
C.反应③中,Na2Fe2O4是氧化剂,Na2FeO2是还原剂 |
D.碱性条件下,NaNO2的氧化性比Na2FeO2、Na2Fe2O4都强 |
1molSO2和1molSO3具有相同的:①分子数;②原子数;③S原子数;④O原子数
| A.①② | B.①③ | C.①④ | D.②④ |
如图为反应Fe + CuSO4 ==FeSO4 + Cu中电子转移的关系图,则图中的元素甲、乙分别表示
| A.Fe Cu | B.Cu S | C.Fe O | D.Fe S |
下列离子方程式正确的是
A.碳酸钙和盐酸反应:CO32-+2H+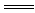 H2O+CO2↑ H2O+CO2↑ |
B.向氢氧化钡溶液中加硫酸溶液:Ba2++SO42-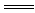 BaSO4↓ BaSO4↓ |
C.向稀盐酸溶液中加铁:3Fe+6H+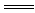 3Fe3++3H2↑ 3Fe3++3H2↑ |
D.向硝酸银溶液中加盐酸:Ag++C1-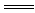 AgCl↓ AgCl↓ |
下列溶液中c(Cl-)与50 mL 1 mol/LAlCl3溶液中c(Cl-)相等的是
| A.150 mL 1 mol/L的NaCl溶液 | B.75 mL 2 mol/L的NH4Cl溶液 |
| C.150 mL 2 mol/L的KCl溶液 | D.75 mL 1 mol/L的FeCl3溶液 |
下列数量的物质中含原子数最多的是
| A.4℃时5.4mL水 | B.标准状况下5.6L二氧化碳 |
| C.0.4mol氧气 | D.10g氖 |