以NA阿伏加德罗常数,下列说法中不正确的是 ()
| A.在常温常压下,14g氮气所含原子数为NA |
| B.在标准状况下,2.24L三氧化硫所含分子数为0.1NA |
| C.在常温常压下,28g的一氧化面和乙烯混合气体,所含分子数为NA |
| D.常温常压下,1mol甲基(—CH3)所含的电子数为9NA |
下列离子方程式,一定不正确的是.
A.实验室用石灰石和盐酸反应制取CO2: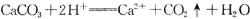 |
B.H2O2溶液中滴加酸性KMnO1溶液: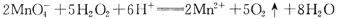 |
C.铁屑溶于过量稀硝酸: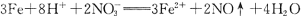 |
D.NaHCO3溶液与足量Ba(OH)2溶液反应: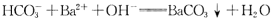 |
下列有关有机物的说法正确的是
A. 所有烷烃分子中都存在碳碳单键,都具有同分异构体
B. 苯、乙醇和乙酸都能发生取代反应和加成反应
C苯和乙烯都能使溴水褪色,但其褪色原理是 不同的
不同的
D.淀粉和葡萄糖都能发生水解
设NA为阿伏加德罗常数,下列说法正确的是
| A.标准状况下22.4L氯气通入足量水中反应,转移的电子数为2NA |
| B.乙烯和氮气组成的28g混合气体中含有分子数为Na |
C.1molNa2O2固体中阳离子和阴离子数均 为2NA 为2NA |
| D.1m0IFeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA |
下列各组物质的性质比较,不正确的是
A.酸性: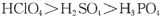 |
B.氢化物稳定性: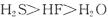 |
C.碱性: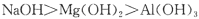 |
D.氧化性: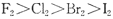 |
在t0C时,将a g NH3完全溶于水,得到V mL溶液,设该溶液的密度为 ,溶质质量分数为w,其中含NH4+物质的量为b mol。下列叙述中正确的是
,溶质质量分数为w,其中含NH4+物质的量为b mol。下列叙述中正确的是
A.溶质的质量分数为 |
B.溶质的物质的量浓度 |
C.溶液中 |
| D.题述溶液中再加人V mL水后,所得溶液的溶质质量分数大于0. 5w |