氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法不正确的是
| A.该反应既是分解反应,又是氧化还原反应 |
| B.变蓝的淀粉碘化钾试纸褪色可能发生的反应: 5C12+I2+6H2O=12H++10Cl—+2IO3— |
| C.若化学计量数a=8,b=3,则该反应转移电子数为20e— |
| D.氯酸分解所得O2和Cl2的物质的量之比是确定不变的 |
下列表示的离子方程式正确的是()
A.NH NO NO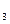 溶液与氢氧化钠共热: 溶液与氢氧化钠共热:H  +OH- +OH- H H O O |
B.NH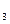 ·H ·H O滴入AlCl3溶液产生沉淀: O滴入AlCl3溶液产生沉淀:3OH  +Al +Al  Al(OH) Al(OH)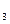 ↓ ↓ |
C.NaOH溶液与NaHCO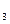 溶液混合: 溶液混合:OH  +H +H  H H O O |
D.Al(OH)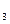 固体溶于稀硫酸中: 固体溶于稀硫酸中: |
Al(OH)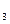 +3H
+3H
 Al
Al +3H
+3H O
O
下列五个反应中氧化剂氧化能力由强到弱的顺序为()
①2Fe+3Cl
 2FeCl
2FeCl
②Fe+2HCl FeCl
FeCl +H
+H ↑
↑
③2KMnO +16HCl(浓)
+16HCl(浓) 2KCl+2MnCl
2KCl+2MnCl +5Cl
+5Cl ↑+8H
↑+8H O
O
④MnO +4HCl(浓)
+4HCl(浓) MnCl
MnCl +Cl
+Cl ↑+2H
↑+2H O
O
⑤O +4HCl(浓)
+4HCl(浓) 2Cl
2Cl ↑+2H
↑+2H O
O
A.Cl >MnO >MnO >O >O >KMnO >KMnO >HCl >HCl |
B.KMnO >MnO >MnO >O >O >Cl >Cl >HCl >HCl |
C.KMnO >O >O >MnO >MnO >Cl >Cl >HCl >HCl |
D.KMnO >O >O >Cl >Cl >MnO >MnO >HCl >HCl |
已知H S是弱电解质,把反应方程式:2FeCl
S是弱电解质,把反应方程式:2FeCl +H
+H S
S FeCl
FeCl +S↓+2HCl用离子方程式表示,正确的是()
+S↓+2HCl用离子方程式表示,正确的是()
A.2Fe +H +H S S 2Fe 2Fe +2H +2H +S↓ +S↓ |
B.Fe +H +H S S Fe Fe +2H +2H +S↓ +S↓ |
C.2Fe +S +S  2Fe 2Fe +S↓ +S↓ |
D.2Fe +2Cl +2Cl +S +S +2H +2H  2Fe 2Fe +S↓+2HCl +S↓+2HCl |
以下是某溶液中含有的浓度较大的离子的检验结论,明显错误的是()
A.Na 、H 、H 、Cl 、Cl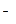 、HCO 、HCO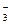 |
B.Ca 、Mg 、Mg 、Cl 、Cl 、Br 、Br |
C.Na 、OH 、OH 、S 、S 、Cl 、Cl |
D.K 、SO 、SO 、NH 、NH 、Cl 、Cl |
RO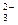 +2R
+2R +6H
+6H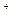
 3R+3H
3R+3H O是某同学作业中的一个离子方程式,其中R
O是某同学作业中的一个离子方程式,其中R 所带电荷模糊不清,若R所带电荷用x表示,则x应是()
所带电荷模糊不清,若R所带电荷用x表示,则x应是()
| A.“+” | B.“2-” |
| C.“3+” | D.“4-” |