氯化铜(CuCl2·2H2O)中含FeCl2杂质。为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示操作步骤进行提纯.

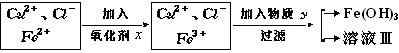
 ↓蒸发结晶
↓蒸发结晶
↓ CuCl2·2H2O(纯)
CuCl2·2H2O(纯)
 氧化剂x与物质Y的化学式分别是(已知完全成氢氧化物所需pH值:Fe3+为3.7,Cu2+为6.4,Fe2+为9.6。) ( )
氧化剂x与物质Y的化学式分别是(已知完全成氢氧化物所需pH值:Fe3+为3.7,Cu2+为6.4,Fe2+为9.6。) ( )

| A.H2O2、CuO | B.KMnO4、Na2O | C.NaClO、Cu(OH)2 | D.K2Cr2O7、NaOH |
1866年凯库勒(下图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释的事实是
| A.苯不能使溴水褪色 | B.苯能与H2发生加成反应 |
| C.溴苯没有同分异构体 | D.间二甲苯只有一种 |
青苹果汁遇碘溶液显蓝色,熟苹果能还原银氨溶液。这说明
| A.青苹果中只含淀粉不含糖类 | B.熟苹果中只含糖类不含淀粉 |
| C.苹果成熟时淀粉水解为单糖 | D.苹果成熟时单糖聚合成淀粉 |
二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是
| A.利用金属钠或者金属钾 | B.利用质谱法 |
| C.利用红外光谱法 | D.利用核磁共振氢谱 |
可以鉴别乙酸溶液、葡萄糖溶液、乙醇溶液的试剂是
| A.银氨溶液 | B.新制氢氧化铜悬浊液 |
| C.石蕊试液 | D.碳酸钠溶液 |
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质.下列说法不正确的是
| A.当人误食重金属盐类时,可以喝大量的牛奶、蛋清解毒 |
| B.淀粉水解的最终产物可与新制的Cu(OH)2反应 |
| C.蛋白质溶液中加入饱和硫酸铵溶液后产生的沉淀能重新溶于水 |
| D.棉、麻、丝、毛完全燃烧只生成CO2和H2O |