孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:xCuCO3·yCu(OH)2(x、y为正整数且x≤2,y≤2)
 (1)孔雀石和石青分别与过量盐酸反应时,孔雀石消耗的盐酸的物质的量与生成的CO2的物质的量之比为4:1;石青则为3:1,请推算它们的化学组成。
(1)孔雀石和石青分别与过量盐酸反应时,孔雀石消耗的盐酸的物质的量与生成的CO2的物质的量之比为4:1;石青则为3:1,请推算它们的化学组成。
 孔雀石__________________________;石青__________________________;
孔雀石__________________________;石青__________________________;
 (2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO2 3.36 L(标准状况下);加热另一份样品使其完全分解,得到CuO 20 g,试通过计算确定该混合物中孔雀石和石青的物质的量之比 。
(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO2 3.36 L(标准状况下);加热另一份样品使其完全分解,得到CuO 20 g,试通过计算确定该混合物中孔雀石和石青的物质的量之比 。
[广东卷]氟乙酸甲酯是一种重要的医药中间体。某合成路线如下:
CH3COOH ClCH2COOH
ClCH2COOH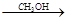 ClCH2COOCH3
ClCH2COOCH3 FCH2COOCH3
FCH2COOCH3
甲乙丙
(1)丙的官能团是 ;乙的化学式是 。
(2)制备甲的反应类型是 。
(3)写出反应方程式:丙+NaOH(足量):
乙→丙:
(4)有人尝试用CH3COOH FCH2COOH,你认为会成功吗?为什么?
FCH2COOH,你认为会成功吗?为什么?
(5)预计丙水溶性如何?能不能形成氢键?
(6)Cl3CCOOH用途广泛,有多种方法制备,试写出方程式
I、用O2氧化四氯乙烯制备: 。
II、用硫粉为催化剂进一步氯化氯乙酸:
(8分)(1) 0.5 mol SO2共约含有个原子,它与gSO3所含硫原子数相等。
(2)质量相同的 ①HCl、②NH3、③CO2、④O2四种气体中,含有分子数目最少的是(填序号) _。
(3)有100mL 0.2 mol/L 的NaOH溶液,将此溶液稀释到200 mL,则溶液中Na+的物质的量是。
【化学——物质结构与性质】短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2 np2,C元素位于第二周期且原子中p亚层与所有s亚层电子总数相等,D元素原子的L层的p亚层中有3个未成对电子。
(1)C元素原子基态时的价电子排布式,若A元素为非金属元素.A与C形成的化合物中的共价键属于键(填“ ”或“
”或“ ”)。
”)。
(2)当n=2时.B的最简单气态氢化物的分子构型为,中心原子的杂化方式为,BC2属于分子(填“极性”或“非极性”),当n=3时,B与C形成的晶体属于____晶体;
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序为(填元素符号)。
(4)下图为C元素与钛钙元素形成的某晶体结构中的最小重复单元,该晶体中每个钛原子周围与它最近且距离相等的钙离子有个,该晶体的化学式为。
【有机物化学基础】
肉桂酸甲酯( )又称苯基丙烯酸甲酯,具有可可香味,主要用于日化和食品工业,是常用的定香剂或食用香精,同时也是重要的有机合成原料。
)又称苯基丙烯酸甲酯,具有可可香味,主要用于日化和食品工业,是常用的定香剂或食用香精,同时也是重要的有机合成原料。
(1)有关肉桂酸甲酯的叙述中,正确的是(填标号)。
A.肉桂酸甲酯的摩尔质量为163g/mol B.无法使酸性高锰酸钾溶液褪色
C.在碱性条件下能发生水解反应 D.能发生加聚反应生成高分子化合物
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如右图所示(图中球与球之间连线表示单键或双键)。G的结构简式为。
(3)用芳香烃A为原料合成G的路线如下:
①化合物E中的官能团有(填名称)。
②B→C该反应的化学方程式为。
③A→B、E→F的反应类型是、。
④符合下列条件的F的同分异构体的结构简式是。
a.分子内含苯环,且苯环上只有一个支链;
b.在一定条件下,lmol该物质与足量银氨溶液充分反应,生成4mol银单质。
合成口服抗菌药琥乙红霉素片的原料G、某种广泛应用于电子领域的高分子化合物I的合成路线如下: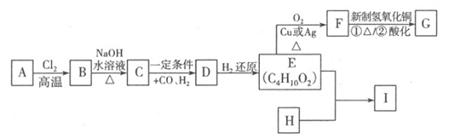
已知:① R—CH2—CH=CH2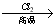 R—CHCl—CH=CH2
R—CHCl—CH=CH2
②R—CH2—CH=CH2 R—CH2CH2CH2CHO
R—CH2CH2CH2CHO
(1)C的结构简式是,E中的官能团的名称是。
(2)写出A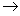 B的反应方程式,该反应类型是。
B的反应方程式,该反应类型是。
(3)H的分子式为C8H6O4,能与碳酸钠溶液反应放出气体,其一氯取代物只有一种,试写出E+H I的反应方程式。
I的反应方程式。
(4)关于G的说法中错误的是 (填序号)。
a.1 mol G最多可与2 mol NaHCO3反应
b.G可发生消去反应
c.1 mol G最多可与2 mol H2发生加成反应
d.1 mol G在一定条件下可与2 mol乙醇发生取代反应