向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3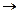 Fe(NO3)3+NO↑+H2O
Fe(NO3)3+NO↑+H2O (1)写出这两个阶段反应的离子方程式.
(1)写出这两个阶段反应的离子方程式. (2)求这两个阶段反应中,加入铁粉的物质的量和溶液中铁元素存在的形式.
(2)求这两个阶段反应中,加入铁粉的物质的量和溶液中铁元素存在的形式. (3)在图中画出溶液中Fe2+、
(3)在图中画出溶液中Fe2+、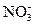 离子的物质的量随加入铁粉的物质的量变化的关系图像(纵坐标是溶液中离子的物质的量).
离子的物质的量随加入铁粉的物质的量变化的关系图像(纵坐标是溶液中离子的物质的量).
(8分)加热10.0克碳酸钠和碳酸氢钠混合物质质量不再变化,剩余固体的质量为8.45克,求混合物中碳酸钠的质量分数。
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。
已知:2Fe2++Br2 2Fe3++2Br-2Fe3++2I-
2Fe3++2Br-2Fe3++2I- 2Fe2++I2
2Fe2++I2
(1)Fe2+、I-、Br-的还原性由强到弱排列顺序为 。
(2)当通入2mol Cl2时,溶液中已发生的离子反应可表示为: 。
(3)原混合溶液中FeBr2的物质的量为 。
(4)原溶液中:n(Fe2+):n(I-):n(Br-)= 。
臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电管来制取臭氧:
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为
g/mol(保留一位小数)。
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为 L。
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g。则原混合气中臭氧的体积分数为 。
(4分)实验室使用的浓盐酸的溶质质量分数一般为36.5%,密度1.19g/cm3.
(1)将____________升氯化氢(标准状况)通入1.00L水中可以得到36.5%的浓盐酸?
(2)该浓盐酸的物质的量浓度为__________________
将4.6克钠加人到95.6克水中,反应完毕后。求:
1)产生的氢气在标况下的体积。
2)所得的氢氧化钠溶液的质量分数。