下列实验操作正确的是 ( )
| A.将氢氧化钠固体放在滤纸上称量 |
| B.用10ml量筒量取8.58mL蒸馏水 |
| C.制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集 |
| D.配置氯化铁溶液时,将一定量氯化铁溶液溶解在较浓的盐酸中,再用水稀释到所需浓度 |
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是()
| A.该电池能够在高温下工作 |
| B.电池的负极反应为C6H12O6+6H2O-24e-====6CO2↑+24H+ |
| C.放电过程中,H+从正极区向负极区迁移 |
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体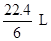 |
(双选)下列溶液中微粒的物质的量浓度关系正确的是()
| A.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B.0.1 mol·L-1 NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+) |
| C.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| D.25 ℃时,pH=4.75、浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
常温下,某溶液中由水电离出来的c(H+)=1.0×10-13 mol·L-1,该溶液可能是()
①二氧化硫溶于水形成的溶液
②氯化铵水溶液
③硝酸钠水溶液
④氢氧化钠水溶液
| A.①④ | B.①② | C.②③ | D.③④ |
根据下图,可判断出下列离子方程式中错误的是()
| A.2Ag(s)+Cd2+(aq)====2Ag+(aq)+Cd(s) |
| B.Co2+(aq)+Cd(s)====Co(s)+Cd2+(aq) |
| C.2Ag+(aq)+Cd(s)====2Ag(s)+Cd2+(aq) |
| D.2Ag+(aq)+Co(s)====2Ag(s)+Co2+(aq) |
强酸和强碱的稀溶液的中和热可表示为:
H+(aq)+OH-(aq)=H2O(l)ΔH="-57.3" kJ·mol-1
已知:
CH3COOH(aq)+NaOH(aq)====CH3COONa(aq)+H2O(l)ΔH=-Q1 kJ·mol-1
1/2H2SO4(浓)+ NaOH(aq)====1/2Na2SO4(aq)+H2O(l)ΔH=- Q 2 kJ·mol-1
HNO3(aq)+KOH(aq)====KNO3(aq)+H2O(l)ΔH=- Q 3 kJ·mol-1
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为()
| A.Q1=Q2= Q3 | B.Q2> Q1> Q3 |
| C.Q2> Q3> Q1 | D.Q2= Q3> Q1 |