不用其它试剂或试纸,仅利用溶液间的相互反应,不能将它们区别开的是 ( )
| A.KNO3、Na2SO4、CaCl2、BaCl2 | B.NaHSO4、MgSO4、Na2CO3、NaOH |
| C.HCl、BaCl2、Na2CO3、NaOH | D.H2SO4、Al2(SO4)3、NaCl、NaOH |
已知磷酸分子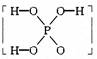 中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换,又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换,由此可推断出H3PO2的分子结构是
中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换,又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不再能跟D2O发生氢交换,由此可推断出H3PO2的分子结构是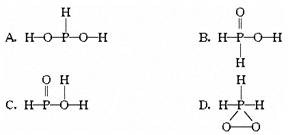
下列分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的是
| A.H2 | B.HCl | C.Cl2 | D.F2 |
某物质的晶体晶胞中含有A、B、C三种元素,其晶胞如图所示(其中前后两面面心中的B元素的原子未能画出)。晶体中A、B、C的原子个数比为
A.1∶3∶1 B.2∶3∶1 C.2∶2∶1 D.1∶3∶3
已知Zn2+的4s轨道和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2—的空间构型为
| A.直线形 | B.平面正方形 | C.正四面体形 | D.正八面体形 |
下列物质属于醇类的是
A.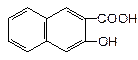 |
B.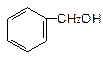 |
C.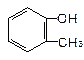 |
D.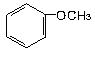 |