(浙江省宁波市鄞州高级中学08-09学年高三上学期期中考试,化学,21)为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是
| A.HCHO溶液(石蕊试液) | B.Na2SO3溶液(BaCl2) |
| C.KI(淀粉溶液) | D.FeCl2溶液(KSCN) |
化学与生活密切相关,下列说法正确的是:
| A.制作航天服的聚酯纤维属于新型无机非金属材料 |
| B.银器久置后表面会变暗,是因为发生了电化学腐蚀 |
| C.Li是最轻的金属也是活动性很强的金属,是制造电池的理想物质 |
| D.海水提取溴、煤的液化、焰色反应都发生了化学变化。 |
如图是四种常见有机物的比例模型示意图。下列说法正确的是 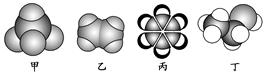
| A.除去甲中混有的少量乙的操作是将混合气体通过盛有酸性KMnO4溶液的洗气瓶。 |
| B.乙和氢气可发生加成反应生成与甲互成同系物的A,A在一定条件下和氯气发生取代反应,最多生成的有机物有六种。 |
| C.丁与丙一样是实验中常用到的萃取剂,并且1mol丁在浓硫酸作用下可与1mol乙酸发生取代反应合成1mol的酯。 |
| D.丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特键,碳原子和氢原子均在同一平面。 |
【原创】水溶液中可能存在Na+、Al3+、Fe2+、NH4+、NO3-、CO32-、SO42-中的基于种离子,且存在的各离子具有相同的物质的量,某同学对该溶液进行如下实验: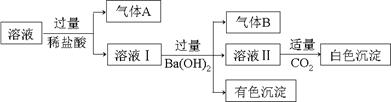
下列判断正确的是
| A.气体A一定是CO2,气体B一定是NH3 |
| B.白色沉淀一定是Al(OH)3 |
| C.溶液中一定存在Al3+、Fe2+、NO3-、NH4+ |
| D.溶液中一定不存在大量Na+ |
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是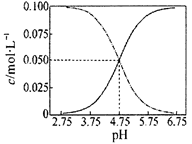
| A.Y点所表示的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| B.W点所表示的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol·L-1 |
| C.该温度下醋酸的电离平衡常数为0.1 mol·L-1 |
| D.向X点所表示的溶液中加入等体积的0.05 mol·L-1 NaOH溶液 :c(H+)=c(CH3COOH)+c(OH-) |
【改编】研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是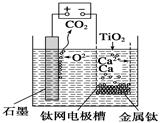
| A.由TiO2制得1 mol金属Ti,理论上外电路转移2 mol电子 |
| B.阳极的电极反应式为C+2O2--4e-==CO2↑ |
| C.在制备金属钛前后,整套装置中CaO的总量减少 |
| D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极 |