在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图)。按此密闭体系中气体的流向,则在A处流出的气体为 ( )


| A.SO2 | B.SO3 O2 | C.SO2 O2 | D.SO2 SO3 |
反应:L(s)+aG(g) bR(g)达到平衡时,温度和压强对该反应的影响如下图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
bR(g)达到平衡时,温度和压强对该反应的影响如下图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断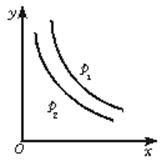
| A.上述反应是放热反应 | B.上述反应是吸热反应 |
| C.a>b | D.a<b |
压强变化不会使下列化学反应的平衡发生移动的是
A.H2(g)+I2(g) 2HI(g) 2HI(g) |
B.3H2(g)+N2(g) 2NH3(g) 2NH3(g) |
C.2SO2(g)+O2(g) 2SO3(g) 2SO3(g) |
D.C(s)+CO2(g) 2CO(g) 2CO(g) |
在一定温度下,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:
X(g)+2Y(g) 2Z(g)
2Z(g)
此反应达到平衡的标志是
| A.容器内压强不随时间变化 |
| B.容器内各物质的浓度不随时间变化 |
| C.容器内X、Y、Z的浓度之比为1∶2∶2 |
| D.单位时间消耗0.1 mol X同时生成0.2 mol Z |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是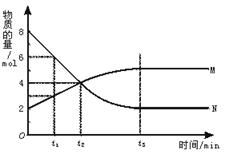
| A.反应的化学方程式为:2M===N |
| B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
在5 L的密闭容器中充入2 mol A气体和1 mol B气体,在一定条件下发生反应:2A(g)+B(g) 2C(g),达平衡时,在相同温度下测得容器内混合气体的压强是反应前的
2C(g),达平衡时,在相同温度下测得容器内混合气体的压强是反应前的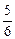 ,则A的转化率为
,则A的转化率为
| A.67% | B.50% | C.25% | D.5% |