研究性学习小组进行SO2的制备及性质探究实验。 (1)根据反应Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2+H2O,制备SO2气体。
(1)根据反应Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2+H2O,制备SO2气体。 ①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
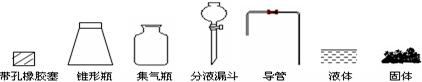
 ②实验过程中,使用分液漏斗滴加浓硫酸的操作是 。
②实验过程中,使用分液漏斗滴加浓硫酸的操作是 。 (2)将SO2气体分别通入下列溶液中:
(2)将SO2气体分别通入下列溶液中: ①品红溶液,现象是 ;
①品红溶液,现象是 ; ②溴水溶液,现象是 ;
②溴水溶液,现象是 ; ③硫化钠溶液,现象是 。
③硫化钠溶液,现象是 。 (3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。 ①原因 ,验证方法 。
①原因 ,验证方法 。 ②原因 ,验证方法 。
②原因 ,验证方法 。 ③原因 ,验证方法 。
③原因 ,验证方法 。
从铝土矿(主要成分是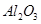 ,含
,含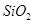 、
、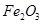 、MgO等杂质)中提取Al2O3的两种工艺品流程如下:
、MgO等杂质)中提取Al2O3的两种工艺品流程如下: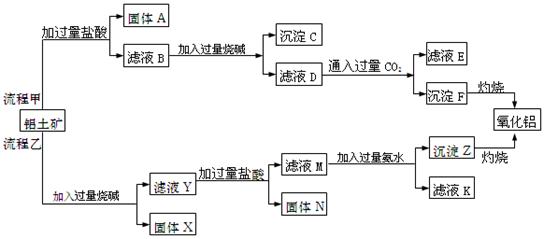
请回答下列问题:
(1)写出相应物质的的化学式:固体A,固体N,
滤液D中溶质为。
(2)流程甲加入盐酸后生成Al3+的离子方程式为。
(3)流程乙加入烧碱后生成水玻璃溶液的化学方程式为。
某金属A及其化合物之间有如下的转化关系: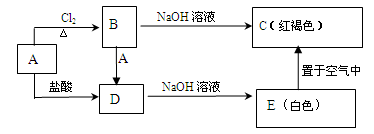
试回答下列问题:
(1)D的溶液与NaOH 溶液混合后的现象是
。
(2)反应B转化成D的离子方程式是。
(3)把B溶液滴入沸水中可以得到红褐色的液体,用一束光通过该液体产生。
(6分)氯水中含有多种成分,因而具有多重性质,根据氯水分别与如图四种物质发生的反应,填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。
(1)能证明氯水具有漂白性的是__________(填“a”、“b”、“c”或“d”)。
(2)C过程中的现象是_______________________,b过程中的离子方程式为______________________。
(3)a过程中的化学方程式为_____________________________。
氯酸钾与浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,反应的化学方程式为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O↑
(1)用双线桥表示上述反应中电子转移的方向和数目。
(2)浓盐酸在该反应中表现的性质是_______________(填序号)。
①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性
(3)上述反应产生0.1molCl2时,转移的电子数为_____________。
(6分)如图A、B、C、D、E各代表铁、水、三氧化硫、盐酸和氢氧化钡中的一种物质。在常温下,相连环物质之间能发生反应,不相连环物质之间不能发生反应。且B的相对分子质量小于D。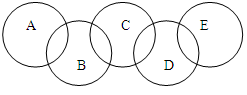
(1)五中物质中属于氧化物的有(填化学式)。
(2)请写出氢氧化钡的电离方程式。
(3)请写出铁与水蒸汽在高温下发生反应的化学方程式
。
(4)请写出下列物质的化学式:B,D(填化学式)。