(海南省万宁市2008届高三年级第一学期期中考试,化学,17)(1)中和热的测定实验(如图)。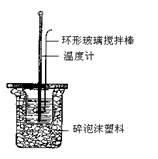
①量取反应物时,取50mL0.50mol·L-1的盐酸,还应加入的试剂是 (填序号)。
A.50mL0.50mol·L-1NaOH溶液
B.50mL0.55mol·L-1NaOH溶液
C.1.0gNaOH固体
②在实验过程中,该同学需要测定并记录的实验数据有 (填序号)。
A.盐酸的浓度 B.盐酸的温度
C.氢氧化钠溶液的浓度 D.氢氧化钠溶液的温度
E.水的比热容 F.反应后混合溶液的终止温度
③若用50mL0.5mol·L-1醋酸溶液代替上述盐酸测定中和热,所得数据 。(填“偏大”或“偏小”或“不变”)
(2)硫酸铜晶体(CuSO4·xH2O)结晶水含量的测定实验。
①称量一定质量硫酸铅晶体后,加热脱结晶水时用到的仪器主要有:玻璃棒、三角架、坩埚、坩埚钳、泥三角和 。
②实验中要将坩埚放在干燥器中冷却,其主要目的是
。
③若坩埚的质量为m,坩埚与硫酸铜晶体的质量为m1,加热后坩埚与无水硫酸铜的质量为m2,则晶体CuSO4·xH2O中x= (写表达式)。
④如果实验中加热温度过高,固体颜色变黑,则测定结果会 (填“不变”或“偏高”或“偏低”)。
下列物质的水溶液能导电,但它属于非电解质的是
| A.CO2 | B.Na2CO3 | C.HCl | D.CaO |
下列离子方程式正确的是:
A.金属钠与水反应:Na+H2O=Na++OH-+ H2↑ H2↑ |
| B.碳酸钠溶液中加入氯化钙溶液:Ca2++CO32-=CaCO3↓ |
| C.醋酸溶液与氢氧化钠溶液反应:H++OH-=H2O |
| D.实验室用石灰石制取CO2:CO32-+2H+=H2O+CO2↑ |
检验某未知溶液中是否含有SO42-,下列操作最合理的是
| A.加入稀硝酸酸化的Ba(NO3)2溶液 | B.加入盐酸酸化的BaCl2溶液 |
| C.先加稀硝酸酸化,再加Ba(NO3)2溶液 | D.先加盐酸酸化,再加BaCl2溶液 |
下列关于胶体的叙述不正确的是
A.布朗运动是 较体微粒特有的运动方 较体微粒特有的运动方 式,可以据此把胶体和溶液、悬浊液区别开来 式,可以据此把胶体和溶液、悬浊液区别开来 |
| B.光线透过胶体时,胶体发生丁达尔现象 |
| C.用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过 |
D.胶体微粒具有较大的表面积,能吸附阳离子或阴离子,在电场作用下会产生电 泳现象 泳现象 |
某元素在化学反应中由以单质形式存在变为以化合物形式存在,则该元素
| A.一定被氧化 | B.一定被还原 |
| C.既可能被氧化也可能被还原 | D.既不可能被氧化也不可能被还原 |