下面是关于硫化氢的部分文献资料。
某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
实验一:将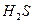 气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1~2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。如图所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1~2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。如图所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
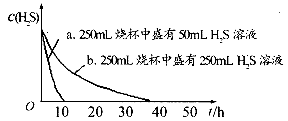
实验二:密闭存放的氢硫酸,每天定时取lml。氢硫酸,用相同浓度的碘水滴定,图所示为氢硫酸浓度随放置天数变化的情况。
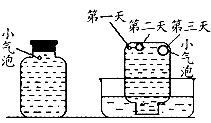
实验三:在饱和氢硫酸溶液中以极慢的速度通人空气(1~2个气泡/min),数小时未见变浑浊的现象(如图)。
实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2~3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2~3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加.这种气泡也略有增多(大),浑浊现象更明显些(如图)。
请回答下列问题:
(1)实验一(图)中,氢硫酸的浓度随时问变化而减小的主要因素是
(2)实验一和实验二中,碘水与氢硫酸反应的化学方程式为 。两个实验中准确判断碘水与氢硫酸恰好完全反应是实验成功的关键。请设计实验方案,使实验者准确掌握所加碘水恰好与氢硫酸完全反应 。
(3)“氢硫酸长期存放会变浑浊”中,出现浑浊现象是由于生成了 的缘故。
(4)该研究性学习小组设计实验三说明他们认为“氢硫酸长期存放会变浑浊”的假设原因之一是(用文字说明) 。此实验中通人空气的速度很慢的主要原因是什么?
(5)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是 。为进一步证实上述原因的准确性,还应做哪些实验(只需用文字说明实验设想,不需要回答实际步骤和设计实验方案)?
下列各组离子中,能在无色溶液中大量共存的是
| A.H+、Ca2+、Cl-、CO32- | B.NO3-、Cl-、K+、H+ |
| C.Na+、Fe3+、SO42-、OH- | D.Na+、Cu2+、Cl-、SO42- |
下列反应的离子方程式中,正确的是
| A.稀硫酸滴在银片上:2Ag+2H+=2Ag++H2↑ |
| B.稀硫酸与氢氧化钡溶液混合:SO42-+Ba2+=BaSO4↓ |
| C.盐酸滴在石灰石上:CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O |
| D.把金属钠放入水中:Na + 2H2O = Na+ +2OH- + H2↑ |
下列叙述正确的是
| A.氯化氢水溶液能导电,所以氯化氢是电解质 |
| B.铜丝能导电,所以铜是电解质 |
| C.固体氢氧化钠不导电,所以氢氧化钠是非电解质 |
| D.SO3溶于水能导电,所以SO3是电解质 |
配制0.1 mol·L-1的硫酸500mL,最适宜的一组仪器是
| A.托盘天平、烧杯、容量瓶、玻璃棒 |
| B.烧杯、玻璃棒、胶头滴管、量筒 |
| C.烧杯、500mL容量瓶、玻璃棒、胶头滴管 |
| D.烧杯、500mL容量瓶、玻璃棒、胶头滴管、量筒 |
下列实验操作中,溶液里不可能有固体析出的是
| A.MgCl2溶液中加入一粒绿豆大小的Na |
| B.饱和Ca(OH)2溶液中加入一粒绿豆大小的Na |
| C.CuSO4溶液中加入一粒绿豆大小的Na |
| D.水中加入一粒绿豆大小的Na |