已知有以下两种反应。①羧酸的钠盐与碱石灰共热,可以发生脱去羧基的反应:
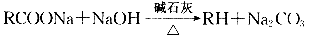
②两个醛分子在一定条件下可以自身加成。下式中反应的中间产物(Ⅲ)可看成是由
(I)中的碳氧双键打开,分别跟(Ⅱ)中的2—位碳原子和2—位氢原子相连而得。
(III)不稳定,受热即脱水而生成不饱和醛(烯醛):
 现有某有机物A的分子式为
现有某有机物A的分子式为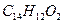 ,在一定条件下按图框图进行反应。其中C完全燃烧生成
,在一定条件下按图框图进行反应。其中C完全燃烧生成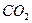 和
和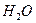 的物质的量比为2:1,且C不能使酸性高锰酸钾溶液褪色。
的物质的量比为2:1,且C不能使酸性高锰酸钾溶液褪色。
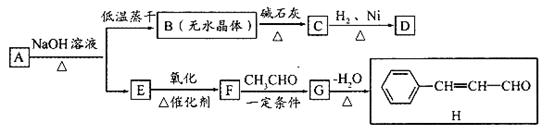
请回答下列问题:
(1)写出有机物A的结构简式: ,其名称是 。
(2)有机物A~H中,属于芳香烃的是 。
(3)写出下列反应的化学方程式:
B→C. ;
E→F. ;
F→G. 。
如图所示装置中,试管内的FeI2溶液中滴有KSCN溶液,实验中控制通入Cl2的速度,试管内先观察到紫色,后观察到红色。下列说法正确的是( )
| A.若Cl2中含较多HCl,实验过程中会产生倒吸现象 |
| B.通入足量Cl2后,振荡试管,下层变紫色,上层变红色 |
| C.该实验可验证氧化性:Cl2>I2>Fe3+ |
| D.试管内反应的离子方程式可表示为Fe2++2I-+Cl2=I2+Fe3++2Cl- |
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
| ①中的物质 |
②中的物质 |
预测①中的现象 |
|
| A |
淀粉-KI溶液 |
浓溴水 |
无明显变化 |
| B |
石蕊溶液 |
硫酸 |
无明显变化 |
| C |
AlCl3溶液 |
浓氨水 |
有白色沉淀 |
| D |
AgNO3溶液 |
浓盐酸 |
有白色沉淀 |
已知反应:①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ·mol-1
③H2(g) O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g)ΔH=-241.8 kJ·mol-1
④H2O(g)=H2O(l)ΔH=-44.0 kJ·mol-1
下列结论正确的是( )
| A.碳的燃烧热大于110.5 kJ·mol-1 |
| B.浓硫酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
| C.氢气的燃烧热为241.8 kJ·mol-1 |
| D.2H2(g)+O2(g)=2H2O(l)的反应热为ΔH=+571.6 kJ·mol-1 |
已知下列热化学方程式:
Na+(g)+Cl-(g)=NaCl(s) ΔH
Na(s)+ Cl2(g)=NaCl(s) ΔH1
Cl2(g)=NaCl(s) ΔH1
Na(s)=Na(g) ΔH2,Na(g)-e-=Na+(g) ΔH3 Cl2(g)=Cl(g) ΔH4,Cl(g)+e-=Cl-(g) ΔH5
Cl2(g)=Cl(g) ΔH4,Cl(g)+e-=Cl-(g) ΔH5
则ΔH与ΔH1、ΔH2、ΔH3、ΔH4、ΔH5的关系正确的是( )
| A.ΔH=ΔH1+ΔH2+ΔH3+ΔH4+ΔH5 |
| B.ΔH=ΔH1-ΔH2-ΔH3-ΔH4-ΔH5 |
| C.ΔH=ΔH1-ΔH2+ΔH3-ΔH4+ΔH5 |
| D.ΔH=ΔH2+ΔH3+ΔH4+ΔH5-ΔH1 |
向足量H2SO4溶液中加入110 mL 0.4 mol/L Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入110 mL 0.4 mol/L HCl溶液时,放出的热量是2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
| A.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-0.72 kJ/mol |
| B.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-2.92 kJ/mol |
| C.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-16.4 kJ/mol |
| D.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-73.0 kJ/mol |