在一定条件下,可实现下列物质间的转化,转化过程如下图所示,
请回答相关问题:
 |
(1)固体A是一种重要的工业原料,其化学式为 。
(2)利用上图中的物质实现 C到B转化过程的离子方程式是 。
(3)上述变化过程中生成的C和丙恰好能完全反应,该反应的化学方程式为:
。
(4)若甲和乙恰好完全反应,则W和A的物质的量之比是 。
如图是某燃煤发电厂处理废气的装置示意图,装置内发生的主要反应中不含( )。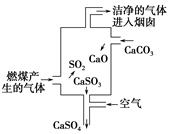
| A.化合反应 | B.分解反应 | C.置换反应 | D.氧化还原反应 |
神舟八号无人飞行器是中国“神舟”系列飞船的第八个,也是中国神舟系列飞船进入批量生产的代表,整个飞船应用了许多尖端的合成材料。下列物质中,不属于合成材料的是( )。
| A.人造丝 | B.有机玻璃 | C.硅橡胶 | D.黏合剂 |
在医院中,为酸中毒病人输液不应采用( )。
| A.0.9%氯化钠溶液 | B.0.9%氯化铵溶液 |
| C.1.25%碳酸氢钠溶液 | D.5%葡萄糖溶液 |
小学生使用的修正液中往往含有某种易挥发的有毒溶剂,应尽量减少或避免使用,这种溶剂可能是下列物质中的( )。
| A.乙醇 | B.乙酸 | C.水 | D.三氯乙烯 |
下列不属于室内主要空气污染物的是()。
| A.SO2 | B.甲醛 | C.苯 | D.PM10 |