按要求回答下列问题:
( 1)某有机物的一个分子含 50 个电子。①若它为烃,则它的分子式可能为______;②若它为含碳、氢、氧的有机物,它的分子式可能是_____________________。(同一个碳原子上连接两个一OH 的结构不稳定)。(每类物质只填一种)
( 2 )常温下,电解 M 的水溶液,在阴、阳两极上产生的气体能发生反应:
X2 + Y2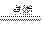 2XY , M的化学式可能是__________________________。
2XY , M的化学式可能是__________________________。
( 3 )符合“化合物(I ) +化合物(II)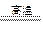 化合物(III)+(化合物(IV )”的化学方程式:_______________________________________________________________
化合物(III)+(化合物(IV )”的化学方程式:_______________________________________________________________
( 4 )某化合物 X 中含钠和硫的质量比为 23 : 16 ,且与盐酸反应放出气体,写出 X 与稀硫酸反应的离子方程式:_______________________________________________。
下列五种物质中,①Ar②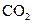 ③金刚石④
③金刚石④ ,⑤NaOH只存在共价键的是,只存在离子键的是,既存在离子键又存在共价键的是,不存在化学键的是。属于共价化合物的是属于离子化合物的是。
,⑤NaOH只存在共价键的是,只存在离子键的是,既存在离子键又存在共价键的是,不存在化学键的是。属于共价化合物的是属于离子化合物的是。
卤块的主要成分是MgCl2,此外还含有少量的Fe3+、Fe2+和Mn2+等离子。以卤块为原料制取轻质氧化镁工艺以及相关数据如下: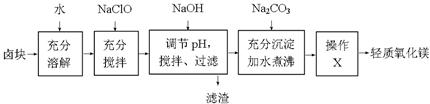
常温下生成氢氧化物沉淀的pH数据:
| 物质 |
开始沉淀时的pH |
沉淀完全时的pH |
| Fe(OH)3 |
2.7 |
3.7 |
| Fe(OH)2 |
7.6 |
9.6 |
| Mn(OH)2 |
8.3 |
9.8 |
| Mg(OH)2 |
9.6 |
11.1 |
回答下列问题:
(1)加入NaClO后产生少量红褐色沉淀。写出加入NaClO后发生的离子反应方程式:_____________________。
(2)为尽量除去杂质,用NaOH调节pH。当溶液pH为________时,停止加入NaOH。
(3)流程图中操作X是_______________。
(4)加入Na2CO3后,加水煮沸的化学方程式为_________________________________。向除去Fe3+、Fe2+和Mn2+等离子后的滤液中改加Na2CO3,而不继续加入NaOH,你认为可能的原因是___________________ __。
“温室效应”是哥本哈根气候变化大会研究的环境问题之一,CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决“温室效应”的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有(填字母编号)。
a.采用节能技术,减少化石燃料的用量 b.鼓励乘坐公交车出行,倡导低碳生活
c.利用太阳能、风能等新型能源替代化石燃料
(2)另一种途径是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l) =C2H4(g)+3O2(g)
ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l) = C2H5OH(1)+3O2(g)错误!未找到引用源。ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇的热化学方程式是。
(3)在一定条件下,6H2(g) +2CO2(g) CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
 CO2转化率(%) CO2转化率(%)n(H2)/n(CO2) |
500 |
600 |
700 |
800 |
| 1.5 |
45 |
33 |
20 |
12 |
| 2 |
60 |
43 |
28 |
15 |
| 3 |
83 |
62 |
37 |
22 |
根据上表中数据分析:
①温度一定时,提高氢碳比[n(H2)/n(CO2)],CO2的转化率(填“增大”、“减小”或“不变”)。
②该反应的正反应为(填“吸热”或“放热”)反应。
③在答卷的坐标系中作图,说明压强由p1增大到p2时,压强对该反应化学平衡的影响(图中纵坐标所表示的物理量需自己定义)。
(16分)氟苯水杨酸(diflunisal)是一种新型的水杨酸类消炎解热镇痛良药,具有强效、长效、低毒等特点。一种可行的合成路线如下(催化剂及溶剂等已省去):
试回答下列问题:
(1)有关氟苯水杨酸的下列说法正确的是(选填序号)。
A.分子中只含两种官能团
B.分子中所有原子可以处于同一平面
C.1mol氟苯水杨酸与足量的碳酸氢钠溶液反应,可生成2molCO2
D.在一定pH条件下,氟苯水杨酸遇FeCl3溶液能发生显色反应
(2)图中有机物(A)为2,4-二氟苯胺,它有多种同分异构体,其中含有苯环和氨基结构的异构体(不含本身)有种。
(3)上述反应中属于取代反应的有:(选填序号:①②③④)。
(4)反应②的方程式为:。
X、Y都是芳香族化合物,均为常见食用香精,广泛用于化妆品、糖果及调味品中。1mol X水解得到1 molY和1mol CH3CH2OH,X、Y的相对分子质量都不超过200,完全燃烧都只生成CO2和H2O。且x分子中碳和氢元素总的质量百分含量约为81.8%。
(1)1个Y分子中应该有个氧原子。
(2)X的分子式是 。
。
(3)G和X互为同分异构体,且具有相同的官能团,用芳香烃A合成G路线如下:
①写出A的结构简式。
②E→ F的反应类型是反应,该反应的化学方程式为。
F的反应类型是反应,该反应的化学方程式为。
③写出所有符合下列条件的F的同分异构体的结构简式:。
i.分子内除了苯环无其他环境结构,且苯环上有2个对位取代基。
ii.一定条件下,该物质既能与银氨溶液发生银镜反应也能和FeCl3溶液发生显色反应。