(2008广东四校水平测试,13)如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是
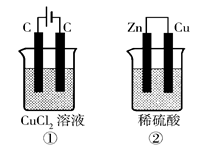
| A.产生气体的体积:①>② |
| B.溶液的pH变化:①减小,②增大 |
| C.电极上析出物质的质量:①>② |
| D.电极反应式:①中阳极 2Cl--2e-Cl2 ↑ ②中负极 2H++2e-H2↑ |
下列操作不能达到目的的是
| 选项 |
目的 |
操作 |
| A |
配制100 mL 1.0 mol/L CuSO4溶液 |
将25 g CuSO4·5H2O溶于100 mL蒸馏水中 |
| B |
用四氯化碳提取碘水中的碘 |
向碘水中加入适量四氯化碳,振荡、静置,分液 |
| C |
在溶液中将MnO4-完全转化为Mn2+ |
向酸性KMnO4溶液中滴加含Fe2+溶液至紫色消失 |
| D |
确定NaCl溶液中是否混有Na2CO3 |
取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
25℃时,水的离子积常数为Kw,该温度下a mol•L-1的HA与bmol•L-1强碱BOH等体积混合,若恰好完全中和,下列结论中不正确的是
A.混合液中:c(H+)≤
B.混合液中:c(HA)+c(A-)=amol•L-1
C.a=b
D.混合液中:c(H+)+c(B+)=c(OH-)+c(A-
下列物质中,当分子中一个氢原子被氯原子取代后,所得产物有两种同分异构体的是
| A.甲烷 | B.乙烷 | C.丙烷 | D.苯 |
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去,下列说法正确的是
| A.处理过程中银器一直保持恒重 |
| B.银器为正极,Ag2S被还原生成单质银 |
| C.该过程中总反应为2Al+3Ag2S=6Ag+Al2S3 |
| D.黑色褪去的原因是黑色Ag2S转化为白色AgCl |
分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些醇和酸重新组合可形成的酯共有
| A.15种 | B.28种 | C.32种 | D.40种 |